
Wetenschap
Waarom is mangaan erg reactief?
* Elektronenconfiguratie: Mangaan heeft een complexe elektronenconfiguratie met gedeeltelijk gevulde D-orbitalen. Dit maakt het minder snel om elektronen gemakkelijk te verliezen en ionen te vormen, vergeleken met elementen met eenvoudigere configuraties.
* oppervlakteoxidelaag: Mangaan vormt een beschermende oxidelaag op het oppervlak, dat fungeert als een barrière voor verdere reactie. Dit passiveringseffect helpt het metaal te beschermen tegen corrosie en verdere reacties.
* relatief hoge ionisatie -energieën: De ionisatie -energieën van mangaan zijn relatief hoog, wat betekent dat er meer energie nodig is om elektronen uit zijn atomen te verwijderen. Hierdoor deelnemen het minder snel deel te nemen aan reacties waarbij de elektronenoverdracht betrokken is.
De reactiviteit van mangaan wordt beïnvloed door factoren zoals:
* Temperatuur: Mangaan wordt reactiever bij hogere temperaturen.
* zuurgraad: Mangaan reageert gemakkelijker in zure omgevingen.
* Aanwezigheid van oxiderende middelen: Oxiderende middelen zoals zuurstof en halogenen kunnen de reactiviteit van mangaan bevorderen.
Hoewel mangaan niet als zeer reactief wordt beschouwd, speelt het nog steeds een belangrijke rol in verschillende industriële processen:
* Steel Making: Mangaan wordt gebruikt in de staalproductie om de sterkte en hardheid te verbeteren.
* batterijen: Mangaan -dioxide is een belangrijk onderdeel in droge celbatterijen.
* pigmenten: Mangaanverbindingen worden gebruikt als pigmenten in verf en keramiek.
Hoewel mangaan niet extreem reactief is, zoals alkali -metalen, is het daarom nog steeds een belangrijk en veelzijdig element met verschillende toepassingen.
 Apparaat simuleert filter- en ionentransportfuncties van menselijke nieren
Apparaat simuleert filter- en ionentransportfuncties van menselijke nieren Wat geeft aan hoe gemakkelijk het is voor een stof om het plasmamembraan over te steken?
Wat geeft aan hoe gemakkelijk het is voor een stof om het plasmamembraan over te steken?  Hoe verhoudt de eigenschappen van ijzer alleen vergeleken met in onverwarmde ijzer-zwavelcombinatie?
Hoe verhoudt de eigenschappen van ijzer alleen vergeleken met in onverwarmde ijzer-zwavelcombinatie?  Wat is de formule voor een ionische verbinding die is gevormd uit aluminium en zuurstof?
Wat is de formule voor een ionische verbinding die is gevormd uit aluminium en zuurstof?  Hoeveel pot in die brownie? Chocolade kan tests afwerpen
Hoeveel pot in die brownie? Chocolade kan tests afwerpen
Hoofdlijnen
- De zoektocht naar de zuidelijke rubberboa
- Welk systeem maakt en brengt hormonen uit?
- Hoe beïnvloeden het uitsterven van andere wezens mensen direct?
- Welke cel heeft vacuolen?
- Het verschil tussen craniologie en frenologie
Craniologie en frenologie zijn beide praktijken die de conformatie van de menselijke schedel onderzoeken; echter, de twee zijn heel verschillend. Craniologie is de studie van verschillen in vorm, groott
- Wat is de naam Worm die papier eet?
- Zijn mensen zonder verstandskiezen hoger ontwikkeld?
- De kattenpest is terug na bijna 40 jaar onderduiken – dit is wat je moet weten
- Wie heeft de spork uitgevonden?
- Het precieze reactiepad lokaliseren:Methaandissociatie op platina
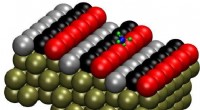
- Spoor, doelwit, trigger:wetenschappers onderzoeken gecontroleerde CO-afgifte
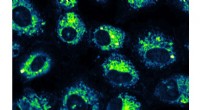
- Nieuwe symmetriedoorbrekende methode opent weg voor bioactieve stoffen

- Onderzoekers gebruiken neurale netwerken voor geurherkenning

- Schudden, rammelaar, en rol naar hoogrenderende fotovoltaïsche energie
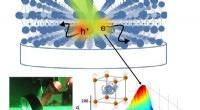
 Zijn er meer bergketens dan continenten in de wereld?
Zijn er meer bergketens dan continenten in de wereld?  Digitaal gemedieerd huiselijk geweld
Digitaal gemedieerd huiselijk geweld Wetenschappers detecteren voor het eerst het rinkelen van een pasgeboren zwart gat
Wetenschappers detecteren voor het eerst het rinkelen van een pasgeboren zwart gat De Noorse Telenor laat Huawei vallen voor Ericsson in 5G-contract
De Noorse Telenor laat Huawei vallen voor Ericsson in 5G-contract Voor het eerst experimenteel aangetoonde sterker-dan-binaire correlaties
Voor het eerst experimenteel aangetoonde sterker-dan-binaire correlaties Processen van evolutie: een kort overzicht
Processen van evolutie: een kort overzicht  Hoe recycle ik Dewalt 18V-batterijen?
Hoe recycle ik Dewalt 18V-batterijen?  Bio-elektronische neus kan voedselbederf detecteren door de geur van de dood te voelen
Bio-elektronische neus kan voedselbederf detecteren door de geur van de dood te voelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

