
Wetenschap
Wat is de naam van samengestelde formule FCI3?
Dit is waarom:
* fluor (f) is zeer elektronegatief, wat betekent dat het sterk elektronen aantrekt. Het vormt meestal slechts één binding.
* chloor (Cl) is ook elektronegatief, maar minder dan fluor. Het kan een of meer bindingen vormen.
* jodium (i) is minder elektronegatief dan chloor.
In een verbinding zoals FCI3 zou het fluoratoom proberen drie bindingen te vormen, wat niet mogelijk is vanwege zijn elektronegativiteit. Bovendien zou de algehele lading van de verbinding +1 zijn, wat onstabiel is.
Mogelijke verbindingen met vergelijkbare elementen:
* if3 (jodium trifluoride): Deze verbinding bestaat en heeft een T-vormige moleculaire geometrie.
* CLF3 (chloor trifluoride): Deze verbinding bestaat ook en heeft een T-vormige moleculaire geometrie.
Het is belangrijk op te merken dat de volgorde van elementen in een formule soms kan worden omgekeerd, afhankelijk van het type verbinding. U kunt bijvoorbeeld CLF3 zien in plaats van FCL3.
 Zijn faseveranderingen fysisch of chemisch van aard?
Zijn faseveranderingen fysisch of chemisch van aard?  Hoe zou u weten dat al het zuur heeft gereageerd bij het toevoegen van zink aan zwavelzuur?
Hoe zou u weten dat al het zuur heeft gereageerd bij het toevoegen van zink aan zwavelzuur?  Helpt bij het reguleren van de ionische samenstelling van CNS extracellulaire vloeistof?
Helpt bij het reguleren van de ionische samenstelling van CNS extracellulaire vloeistof?  Millimolars berekenen
Millimolars berekenen  Wat is de formule van de ionische verbinding gevormd door magnesium- en fosforatomen?
Wat is de formule van de ionische verbinding gevormd door magnesium- en fosforatomen?
 Moeder, Dochter klaagt Frankrijk aan wegens slechte gezondheid door luchtvervuiling
Moeder, Dochter klaagt Frankrijk aan wegens slechte gezondheid door luchtvervuiling Wat kan ervoor zorgen dat de Mississippi-bocht hypoxisch wordt?
Wat kan ervoor zorgen dat de Mississippi-bocht hypoxisch wordt? Lava stroomt uit krater terwijl de Indonesische berg Merapi uitbarst
Lava stroomt uit krater terwijl de Indonesische berg Merapi uitbarst Wil je anderen aansporen om zonnepanelen te installeren? Geen woorden maar daden
Wil je anderen aansporen om zonnepanelen te installeren? Geen woorden maar daden Als burgerwetenschappers boeren kunnen belangrijke bijdrage leveren aan klimaatadaptatie
Als burgerwetenschappers boeren kunnen belangrijke bijdrage leveren aan klimaatadaptatie
Hoofdlijnen
- Een botanistische hypothese dat alle uiencellen dezelfde vorm hebben, hoe zou u dit ergvesten of dit weerleggen?
- Hoe zijn zowel cel- als celmembraan?
- Het symposium in Pittsburgh antwoordt:Wat is Watson?
- Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van enzymactiviteit?
- Wetenschappers visualiseren de structuur van de belangrijkste DNA-reparatiecomponent met een bijna-atomaire resolutie
- Onderzoek onthult dat controversiële insecticiden giftig zijn voor zangvogels
- Wat zijn protosme's?
- Wat beschrijft 2 soorten die zo nauw samenwerken dat ze aan elkaar zijn aangepast?
- Wat zijn chrysophytes?
- Computersimulaties van eiwitten helpen te ontrafelen waarom resistentie tegen chemotherapie optreedt
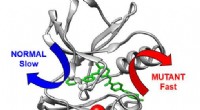
- Een moleculaire snelkookpan maakt taaie stukjes eiwit mals en helpt af te bijten
- Nieuwe microscopie werkt bij extreme hitte, werpt licht op legeringen voor kernreactoren

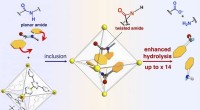
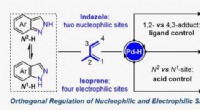
- Orthogonale regulatiestrategie biedt nieuwe kansen voor opbouw van moleculaire complexiteit
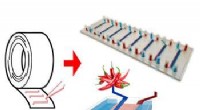
- Met gewone tape, onderzoekers maken chip die de ontwikkeling van medicijnen kan versnellen
 Studie onthult tienjarige variatie in relatie tussen Oost-Aziatische zomermoesson en El Nino
Studie onthult tienjarige variatie in relatie tussen Oost-Aziatische zomermoesson en El Nino Radiosignalen van verre sterren suggereren verborgen planeten
Radiosignalen van verre sterren suggereren verborgen planeten Wat is de wet van Boyle en waarom weet ik deze al?
Wat is de wet van Boyle en waarom weet ik deze al?  Nieuwe muziekstijlen gedreven door directe uitdagingen voor elites
Nieuwe muziekstijlen gedreven door directe uitdagingen voor elites Wat zijn cellen met en zonder een kern genoemd?
Wat zijn cellen met en zonder een kern genoemd?  Simpele statistieken kunnen goed genoeg zijn
Simpele statistieken kunnen goed genoeg zijn Keppel-koralen tonen veerkracht na ernstige verbleking
Keppel-koralen tonen veerkracht na ernstige verbleking  De waarde van samenwerking voor duurzame ontwikkeling in grensoverschrijdende stroomgebieden
De waarde van samenwerking voor duurzame ontwikkeling in grensoverschrijdende stroomgebieden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

