
Wetenschap
Een moleculaire snelkookpan maakt taaie stukjes eiwit mals en helpt af te bijten
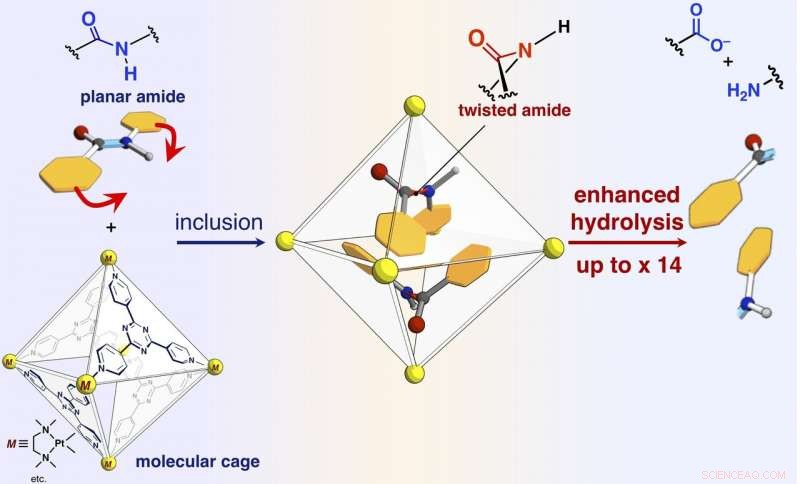
Een schema van reactiesnelheidversnelling van amidehydrolyse door opname in de zelf-geassembleerde moleculaire kooi. Krediet:NINS/IMS
Eiwitten zijn samengesteld uit aminozuren verbonden door amidebindingen. De amidebinding vertoont een hoge chemische stabiliteit en heeft een vlakke structuur rond de binding. Hoewel de hoge stabiliteit van de amidebinding onontbeerlijk is voor het in stand houden van eiwitfuncties, het is problematisch om de bouwsteen om te zetten in een andere moleculaire soort door selectieve dissociatie van een relevante amidebinding.
Er zijn pogingen geweest om de reactiviteit van een specifieke amidebinding te regelen via selectieve verdraaiing door gecompliceerde chemische modificaties. Sommige modelverbindingen met gedraaide amidebindingen zijn geproduceerd door organische synthese in meerdere stappen, en hun hoge reactiviteit is aangetoond. Aangenomen wordt dat de hoge reactiviteit van deze getwiste amidebindingen ook in vivo wordt gebruikt. Sommige eiwitten lijken selectief te worden gesplitst door specifieke amidebindingen te verdraaien tijdens autolyse en splicing. Deze eiwitten, in tegenstelling tot kunstmatig gesynthetiseerde modelverbindingen, worden verondersteld niet-covalente interacties te gebruiken om hun amidebindingen te verdraaien. Voor vele jaren, onderzoekers van de Universiteit van Tokyo en het Instituut voor Moleculaire Wetenschappen hebben moleculaire kooien gefabriceerd die zelf-geassembleerd zijn door niet-covalente interacties. Ze pasten hun moleculaire kooien toe om amidemoleculen op te sluiten, die kunnen worden beschouwd als analogen van kleine stukjes eiwitten, en perste de amidebindingen door ze in hun kooi onder druk te zetten.
De onderzoekers hebben in het huidige artikel gerapporteerd dat amidebindingen, die vlakke structuren hebben en inert zijn in de vrije ruimte, kan worden gedraaid, en de amideverbindingen kunnen worden geactiveerd door ze op te sluiten in hun moleculaire kooi (getoond in figuur). Wanneer doelamideverbindingen en de moleculaire kooi worden gemengd en verwarmd in een waterige oplossing, de kooi beperkt de amideverbindingen. Eenkristal-röntgenstructuuranalyse onthulde dat twee amideverbindingen met gedraaide structuren in de kooi zijn opgesloten. De draaihoek rond de amidebindingen bleek 34 graden te bereiken. De reactiesnelheid van hydrolyse van het gedraaide doelwit werd met een factor vijf versneld. De onderzoekers slaagden erin een nieuw kunstmatig enzym te creëren van een voorheen onbenut mechanisme dat de doelmoleculen opsluit en verdraait om een specifieke chemische binding te activeren.
De onderzoekers slaagden er ook in de reactiviteit van doelmoleculen te veranderen door "opvulmoleculen, " die niet betrokken zijn bij de reactie, samen met de doelen in de kooi, waardoor de mate van verdraaiing van de amidebindingen nauwkeurig wordt geregeld. Zonder het opvulmolecuul, de twee doelamiden zijn opgesloten in één kooi. Een van de twee doelen is gedraaid en de andere blijft vlak. In tegenstelling tot, wanneer conische vulling wordt gemengd en vervolgens samen met het doelwit in één kooi wordt betrokken, het doel blijft vlak. Wanneer een planair opvulmolecuul betrokken is bij het doelwit, de vulling verandert de vorm van het doelwit in een gedraaide structuur. De onderzoekers onderzochten de reactiesnelheden van hydrolyse in de twee gevallen en ontdekten dat de vlakke vulling (twisted target) de snelheid met 14 keer versnelt, terwijl de conische vulling (vlakke doel) de snelheid met drie keer versnelde. Met de opvulmoleculen kunnen de onderzoekers de reactiesnelheid nauwkeurig afstemmen. Dit is een ongekende prestatie die nog nooit in eerdere studies is gevonden. Dit onderzoek biedt een nieuwe methode voor de activering van inerte moleculen en kan worden toegepast op een verscheidenheid aan organische reacties.
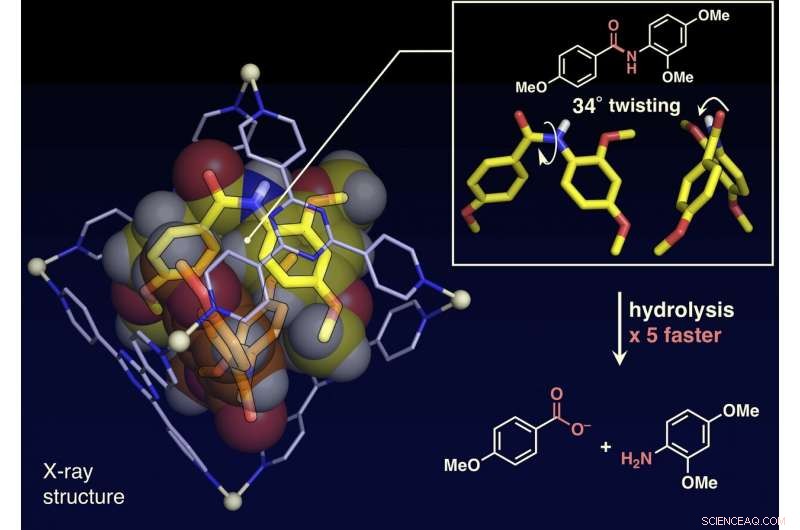
De eenkristalstructuuranalyse toonde aan dat de vlakke amidemoleculen tot 34 graden in de kooi waren gedraaid. De snelheid van hydrolyse door een base werd met een factor vijf versneld. Krediet:NINS/IMS
De onderzoekers toonden aan dat de amidemoleculen kunnen worden geactiveerd door in de kooi te draaien zonder omslachtige chemische modificatieprocessen. "We zijn op zoek naar een nieuw type kooi dat de doelen met een hogere efficiëntie kan activeren en toepassen op andere categorieën doelmoleculen. Met onze nieuwe kooien, we zullen de nieuwe activeringsmethode van inerte moleculen ontwikkelen. In de toekomst, onze kooien zullen worden gebruikt als katalysatoren, die selectief een specifieke binding van een doelmolecuul samenknijpen en activeren en ook als activatiemiddelen voor prodrugs die in het lichaam werken, ’ zei Fujita.
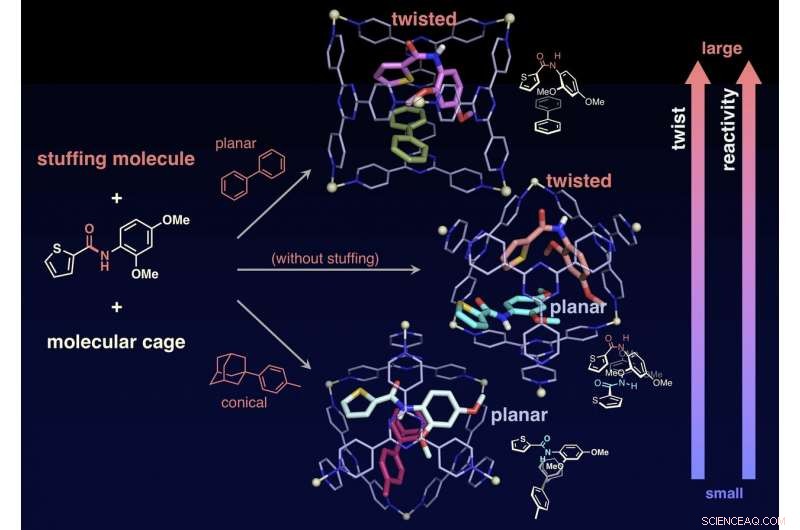
De draaihoek, en dan de reactiviteit naar hydrolyse, kan worden gecontroleerd door het opvulmolecuul samen met het doelamide in de kooi op te sluiten. Krediet:NINS/IMS
 Wat is het effect van temperatuur op toestanden van materie?
Wat is het effect van temperatuur op toestanden van materie?  Nieuwe inzichten in de groei van nanokristallen in vloeistof
Nieuwe inzichten in de groei van nanokristallen in vloeistof Multi-state schakelbare stationaire fase opent nieuwe deuren in chirale scheiding
Multi-state schakelbare stationaire fase opent nieuwe deuren in chirale scheiding Dynamische hydrogel die wordt gebruikt om zachte robotcomponenten en LEGO-achtige bouwstenen te maken
Dynamische hydrogel die wordt gebruikt om zachte robotcomponenten en LEGO-achtige bouwstenen te maken Lab verandert fluorescerende tags in kankermoordenaars
Lab verandert fluorescerende tags in kankermoordenaars
 Uit nieuw onderzoek blijkt dat baby's op weg naar school meer worden blootgesteld aan schadelijke vervuiling dan op weg naar huis
Uit nieuw onderzoek blijkt dat baby's op weg naar school meer worden blootgesteld aan schadelijke vervuiling dan op weg naar huis Het begrijpen van door bosbranden veroorzaakte onweersbuien kan levens redden
Het begrijpen van door bosbranden veroorzaakte onweersbuien kan levens redden Nog één keer:Olympische podia 2020 gemaakt van gerecycled plastic
Nog één keer:Olympische podia 2020 gemaakt van gerecycled plastic De methaanemissies in de Bay Area zijn mogelijk het dubbele van wat we dachten
De methaanemissies in de Bay Area zijn mogelijk het dubbele van wat we dachten How Do Bears Mate?
How Do Bears Mate?
Hoofdlijnen
- Geluidsoverlast veroorzaakt chronische stress bij vogels, met gezondheidsgevolgen voor jongeren
- Kijk hoe bacteriën muteren tot medicijnresistente superbacteriën
- Wat is een eigenschap die het resultaat is van twee dominante genen?
- Het ochtendkoor horen:Okina was een nieuw akoestisch monitoringnetwerk
- Zelfgemaakte UV-sterilisator
- Hoe herstelt de huid?
- Gemakkelijke manieren om botten te herkennen in anatomie
- Relaties tussen mitose in eukaryote cellen en binaire fissie in Prokaryoten
- Wat is Supplex Nylon?
- Gerecycled katoen wordt nieuwe stof

- Residu van stabilisator in inkten blijkt de geleidbaarheid in 3D-geprinte elektronica te remmen

- Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken

- Wetenschappers ontwikkelen supergevoelige sensoren voor spiegelmoleculen in medicijnen
- Transplantatiebeschadigend virus komt in beeld
 Astronomen verklaren de vorming van zeven exoplaneten rond Trappist-1
Astronomen verklaren de vorming van zeven exoplaneten rond Trappist-1 Hoe buitenlandse aankopen van Amerikaanse huizen de prijzen en het aanbod beïnvloeden?
Hoe buitenlandse aankopen van Amerikaanse huizen de prijzen en het aanbod beïnvloeden? Bingewatchen van politieke drama's met vrouwelijke personages kan je verslaafd maken aan politiek
Bingewatchen van politieke drama's met vrouwelijke personages kan je verslaafd maken aan politiek Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren
Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren Neutronen turen in een draaiende motor
Neutronen turen in een draaiende motor Wat zijn de aanpassingen voor overleving voor zeegras?
Wat zijn de aanpassingen voor overleving voor zeegras?  Meer kinderen in gezinnen met meerdere generaties
Meer kinderen in gezinnen met meerdere generaties Nat en stormachtig weer teisterde de kust van Californië... 8, 200 jaar geleden
Nat en stormachtig weer teisterde de kust van Californië... 8, 200 jaar geleden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

