
Wetenschap
Computersimulaties van eiwitten helpen te ontrafelen waarom resistentie tegen chemotherapie optreedt
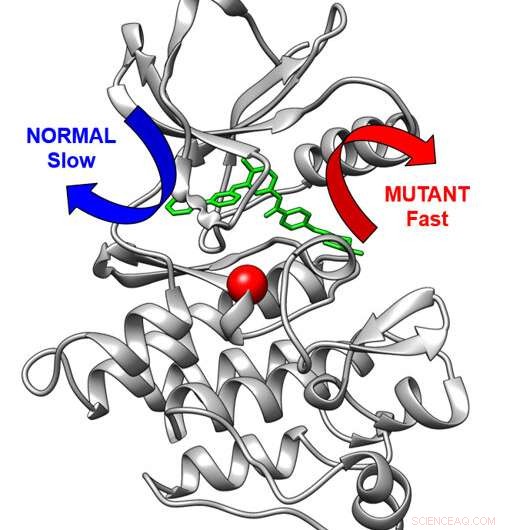
Driedimensionale structuur van het kankergeneesmiddeldoelwit Abl-kinase (grijs) gebonden aan het antikankergeneesmiddel imatinib. Normaal gesproken verlaat het medicijn langzamer via de blauwe pijl. Een wijziging in het kinase (rode bol) zorgt ervoor dat het medicijn via een snelle route naar buiten gaat (rode pijl). Krediet:Aziz M. Rangwala
Begrijpen waarom en hoe resistentie tegen chemotherapie optreedt, is een belangrijke stap in de richting van het optimaliseren van behandelingen voor kanker. Een team van wetenschappers, waaronder Markus Seeliger, Ph.D., van het Stony Brook Cancer Center en Renaissance School of Medicine aan de Stony Brook University, gelooft dat ze een nieuw proces hebben gevonden waardoor resistentie tegen geneesmiddelen plaatsvindt. Ze gebruiken een computersimulatiemodel dat hen helpt precies te begrijpen hoe moleculen interageren met het kankermedicijn Imatinib (bekend als Gleevec) in het chemotherapie-resistente proces. Imatinib behandelt chronische myeloïde leukemie (CML) zeer effectief, maar veel patiënten in een laat stadium ervaren resistentie tegen geneesmiddelen, waardoor het medicijn in dat stadium minimaal effectief is.
Het onderzoek wordt benadrukt in een paper gepubliceerd in Angewandte Chemie en bouwt voort op eerder onderzoek dat in 2021 is uitgewerkt in PNAS .
Imatinib remt het BCR-Abl-eiwitkinase, een overactieve cellulaire signaleringsmachinerie in CML. In de PNAS studie toonden onderzoekers aan dat variaties in het bouwplan van het kinase het voor Imatinib moeilijker kunnen maken om aan het kinase te binden en ook de afgifte van geneesmiddelen uit het kinase te versnellen. In de Angewandte Chemie paper, het onderzoeksteam nam de computationele methodologie - ontwikkeld door co-auteur Pratyush Tiwary van de Universiteit van Maryland - waarmee ze de zeer langzame afgifte van Imatinib uit de kinase konden bestuderen.
"Deze methode is op zichzelf al een belangrijke technische prestatie die de rekencapaciteit voor onderzoek naar resistentie tegen geneesmiddelen uitbreidt, en wat er vooral toe heeft geleid dat we konden voorspellen hoe snel gezonde en gemuteerde eiwitten dit medicijn zouden afgeven", zegt Seeliger, universitair hoofddocent bij de afdeling Farmacologische Wetenschappen. "Voor het eerst konden we de afgifte van een medicijn uit een eiwit in zo'n detail en nauwkeurigheid zien. Bovendien konden we aantonen dat de mutatie fundamenteel verandert binnen de exitroute van het medicijn uit het eiwit.
"Dit is belangrijk omdat de snelheid van de medicijnafgifte net zo belangrijk kan zijn voor het therapeutische effect van een medicijn als hoe stevig een medicijn aan het eiwit bindt."
Seeliger legt verder uit dat de methode een basis zou kunnen bieden voor het begrijpen van de moleculaire mechanismen achter resistentie tegen chemotherapie.
Meer in het algemeen zijn de implicaties van wat ze ontdekten dat als wetenschappers kunnen begrijpen hoe medicijnen uit hun eiwitten worden vrijgegeven, ze mogelijk medicijnen kunnen ontwerpen met een langzamere afgifte en een grotere therapeutische impact. Bovendien, als snelle medicijnafgifte resistentie tegen medicijnen zou kunnen veroorzaken en clinici kunnen aantonen dat dit gebeurt, kunnen ze de effectiviteit van het medicijn mogelijk opnieuw activeren door de patiënt te vragen het medicijn vaker in te nemen.
De basis voor het testen van mutaties via de computationele methode werd uiteengezet in de PNAS papier. Seeliger en collega's hebben getest hoe imatinib zich bindt aan mutaties bij patiënten met imatinib-resistente CML. Ze ontdekten dat de meeste mutaties gemakkelijk binden aan imatinib, dus de vraag hoe deze mutaties resistentie veroorzaken bij patiënten? De onderzoekers identificeerden vervolgens verschillende mutanten die imatinib gemakkelijk bonden, maar ze geven het medicijn veel sneller af.
Na het identificeren van deze mutanten met een snellere afgifte van geneesmiddelen, gebruikte het team nucleaire magnetische resonantie (NMR) en moleculaire dynamica om het eiwit te koppelen aan disassociatie van geneesmiddelen, wat ten grondslag ligt aan het belang van disassociatie-kinetiek van geneesmiddelen voor de werkzaamheid van geneesmiddelen. Dit stelde hen in staat een nieuw mechanisme van imatinibresistentie te identificeren.
Het werk dat resulteerde in het artikel gepubliceerd in PNAS omvatte de gezamenlijke inspanningen van Seeliger en zijn collega's bij Stony Brook, en onderzoekers van het Memorial Sloan Kettering Cancer Center en de Goethe-universiteit van Frankfurt, Duitsland.
Onderzoek dat resulteerde in de meer recente paper werd geleid door Tiwary en collega's van de Universiteit van Maryland, in samenwerking met Seeliger en wetenschappers van het Broad Institute van MIT en Harvard University. + Verder verkennen
Nieuwe computersimulatie doorbreekt mysterie van resistentie tegen kankermedicijnen
 Klimaatverandering zorgt voor hevigere stormen in heel Europa
Klimaatverandering zorgt voor hevigere stormen in heel Europa NASA-NOAA-satelliet vindt cycloon Hikaa aan de kust van Omans
NASA-NOAA-satelliet vindt cycloon Hikaa aan de kust van Omans NASA ontdekt dat nieuwe tropische storm Selma veel regen kan veroorzaken
NASA ontdekt dat nieuwe tropische storm Selma veel regen kan veroorzaken Relikwieën uit de Tweede Wereldoorlog blijven de Stille Oceaan achtervolgen
Relikwieën uit de Tweede Wereldoorlog blijven de Stille Oceaan achtervolgen  NGO's verwerpen plan van VN-luchtvaartagentschap voor biobrandstoffen
NGO's verwerpen plan van VN-luchtvaartagentschap voor biobrandstoffen
Hoofdlijnen
- Wat is een CFU in de microbiologie?
- Basisvereisten voor groei in prokaryoten en eukaryoten
- Antropologen beschrijven derde orang-oetansoort
- Wat breekt een dubbele DNA-helix uiteen?
- Voetafdrukken gebruiken om reuzenpanda's in het wild te identificeren en te volgen
- Wat zijn wierook en mirre?
- Nieuwe technologie verlicht microben die niet in een laboratorium kunnen worden gekweekt
- Bang voor spinnen? Het kan in je DNA zitten
- Genetisch verhogen van de voedingswaarde van maïs kan miljoenen ten goede komen
- Pervaporatiemembranen zijn veelbelovend voor de terugwinning van alkalisch afvalwater
- Gebouwen in menselijk bot kunnen de sleutel zijn tot sterkere 3D-geprinte lichtgewicht structuren

- Universele latente aniondonoren voor ultralage werkfunctie-oplossing-verwerkbare elektroden

- Chemici bedenken nieuwe Lewis-zuurtest met behulp van fluorescentie

- Chemici ontdekken nieuwe kenmerken om cystische fibrose bij zuigelingen eerder te identificeren

 Palestijnse tieners bereiken finale van app-pitch in Silicon Valley
Palestijnse tieners bereiken finale van app-pitch in Silicon Valley Een calculator gebruiken om het percentage te berekenen
Een calculator gebruiken om het percentage te berekenen  Door de mens gemaakte vezels en plastic gevonden in de diepste levende organismen
Door de mens gemaakte vezels en plastic gevonden in de diepste levende organismen Hulpbron-efficiënt zacht exoskelet voor mensen met loopbeperkingen
Hulpbron-efficiënt zacht exoskelet voor mensen met loopbeperkingen De beweging en de gevolgen van microplasticvervuiling voorspellen
De beweging en de gevolgen van microplasticvervuiling voorspellen Polymeer dat geneest als een huid, zeer dicht bij productie op industriële schaal
Polymeer dat geneest als een huid, zeer dicht bij productie op industriële schaal Nieuw fossiel van zoogdieren uit het Krijt werpt licht op de evolutie van het middenoor
Nieuw fossiel van zoogdieren uit het Krijt werpt licht op de evolutie van het middenoor Naarmate de temperatuur stijgt, boeren planten gewassen in S.Koreaanse tunnel
Naarmate de temperatuur stijgt, boeren planten gewassen in S.Koreaanse tunnel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

