
Wetenschap
Wat houdt moleculen bij elkaar?
1. Intramoleculaire krachten: Deze krachten bestaan * binnen * een molecuul, die de atomen bij elkaar houden om het molecuul zelf te vormen. De sterkste van deze krachten zijn chemische bindingen , die van drie hoofdtypen kunnen zijn:
* Covalente bindingen: Deze bindingen omvatten het delen van elektronen tussen atomen. Dit is het meest voorkomende type binding in organische moleculen, zoals water (H₂o) en methaan (CH₄).
* ionische bindingen: Deze bindingen vormen zich wanneer het ene atoom een elektron verliest aan een ander atoom, waardoor tegengesteld geladen ionen ontstaan die zich tot elkaar aangetrokken voelen. Voorbeelden hiervan zijn tabelzout (NaCl) en kaliumchloride (KCL).
* metalen bindingen: Deze bindingen komen voor in metalen waar elektronen worden gedelokaliseerd en vrij om door de gehele metaalstructuur te bewegen. Dit geeft metalen hun karakteristieke eigenschappen zoals geleidbaarheid en kneedbaarheid.
2. Intermoleculaire krachten: Deze krachten bestaan * tussen * moleculen, houden ze bij elkaar en beïnvloeden de fysieke eigenschappen van stoffen zoals hun smeltpunt en kookpunt. Ze zijn over het algemeen zwakker dan intramoleculaire krachten, maar spelen nog steeds een belangrijke rol bij het bepalen van het gedrag van materie. Enkele veel voorkomende intermoleculaire krachten zijn:
* waterstofbinding: Dit is een sterk type intermoleculaire kracht die optreedt wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom zoals zuurstof, stikstof of fluor. Dit creëert een dipoolmoment, wat leidt tot sterke attracties tussen moleculen. Water is een goed voorbeeld van een stof die waterstofbinding vertoont.
* Dipole-dipole interacties: Deze interacties treden op tussen polaire moleculen, waarbij het ene uiteinde van het molecuul een gedeeltelijke positieve lading heeft en het andere uiteinde een gedeeltelijke negatieve lading heeft. Deze gedeeltelijke ladingen trekken elkaar aan, wat leidt tot een zwakkere aantrekkingskracht dan waterstofbinding.
* Dispersietroepen in Londen: Dit zijn de zwakste intermoleculaire krachten, aanwezig in alle moleculen. Ze komen voort uit tijdelijke schommelingen in elektronenverdeling, waardoor tijdelijke dipolen ontstaan die dipolen in naburige moleculen veroorzaken. Deze krachten zijn vooral belangrijk in niet -polaire moleculen.
Het type en de sterkte van de krachten die moleculen tegen elkaar houden, bepalen de toestand van materie (vaste, vloeistof of gas) en verschillende andere eigenschappen zoals viscositeit, oppervlaktespanning en vluchtigheid.
 Hoe heet het molecuul dat fosfor bevat?
Hoe heet het molecuul dat fosfor bevat?  Hoe noem je de vrijgegeven warmte wanneer 1 mol van een stof volledige verbranding ondergaat?
Hoe noem je de vrijgegeven warmte wanneer 1 mol van een stof volledige verbranding ondergaat?  Hoe noem je een proces waarbij een zuur en een base elkaar neutraliseren?
Hoe noem je een proces waarbij een zuur en een base elkaar neutraliseren?  Wat is een onoplosbare stof die door filtratie van water wordt gescheiden?
Wat is een onoplosbare stof die door filtratie van water wordt gescheiden?  Wat zijn voorbeelden van luchtverontreinigende stoffen?
Wat zijn voorbeelden van luchtverontreinigende stoffen?
 Planten in de Canopy Layer of the Rainforest
Planten in de Canopy Layer of the Rainforest  Wat betekent St. Thomas Aquinas als hij zegt dat Grace voortbouwt op de natuur?
Wat betekent St. Thomas Aquinas als hij zegt dat Grace voortbouwt op de natuur?  NASA onderzoekt hoe bosbranden in het Noordpoolgebied de wereld veranderen
NASA onderzoekt hoe bosbranden in het Noordpoolgebied de wereld veranderen  Een licht schijnen op giftige chemicaliën remt industrieel gebruik
Een licht schijnen op giftige chemicaliën remt industrieel gebruik Door vuur beschadigde bomen registreren 700 jaar natuurlijke en culturele brandgeschiedenis in een noordelijk bos
Door vuur beschadigde bomen registreren 700 jaar natuurlijke en culturele brandgeschiedenis in een noordelijk bos
Hoofdlijnen
- Wat is de wetenschappelijke methode in orde?
- Aminozuursupplement is een sleutel tot reproductieve gezondheid bij melkkoeien
- Waar wordt ATP het meest efficiënt geproduceerd?
- Wat is de definitie van vlezige penwortel?
- Verlies en hoop:Amerikaanse parkwachters bestrijden de klimaatcrisis
- Hoe naamsverandering de carrière van een vrouwelijke onderzoeker kan beïnvloeden
- Grootste database over zoogdieren in Portugal nu beschikbaar
- Wat is de rol van zijderupsen in het ecosysteem?
- Welke weefsels zorgen ervoor dat organen niet uit elkaar vallen?
- Observatie van quasi-evenwichtsfase coëxistentie in superkritische vloeistoffen

- Een nieuwe boosdoener in antibacteriële resistentie:cysteïnepersulfide
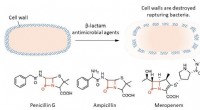
- Nieuwe technieken om de houdbaarheid van ons voedsel te verbeteren, kunnen het oogstverlies helpen minimaliseren

- Nu kunnen metalen oppervlakken onmiddellijke bacteriedoders zijn

- Machine learning-analyse van röntgengegevens selecteert belangrijke katalytische eigenschappen
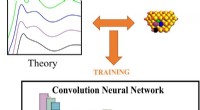
 Wat zijn de functies van Triglyceride Phospholipid & Sterol?
Wat zijn de functies van Triglyceride Phospholipid & Sterol?  Nieuwe studie onderzoekt kenmerken van forenzen en blootstelling aan verkeersvervuiling onder forenzen
Nieuwe studie onderzoekt kenmerken van forenzen en blootstelling aan verkeersvervuiling onder forenzen Model laat zien hoe vissen staartvinnen synchroniseren om energie te besparen
Model laat zien hoe vissen staartvinnen synchroniseren om energie te besparen  Grote klimaatrekening dwingt Amerikaanse energie om groener te worden
Grote klimaatrekening dwingt Amerikaanse energie om groener te worden Uit onderzoek blijkt dat leeftijd de drijvende kracht is achter het veranderen van de manier waarop sterren in sterrenstelsels bewegen
Uit onderzoek blijkt dat leeftijd de drijvende kracht is achter het veranderen van de manier waarop sterren in sterrenstelsels bewegen  Open data toont bliksem, geen brandstichting, was de waarschijnlijke oorzaak van de meeste Victoriaanse bosbranden afgelopen zomer
Open data toont bliksem, geen brandstichting, was de waarschijnlijke oorzaak van de meeste Victoriaanse bosbranden afgelopen zomer Koningsgetijden zijn een blik in de toekomst met stijgende zeeën. Voor velen, overstromingen is het nieuwe normaal
Koningsgetijden zijn een blik in de toekomst met stijgende zeeën. Voor velen, overstromingen is het nieuwe normaal Beyond Bennu:hoe OSIRIS-REx wetenschappers helpt de sonische signatuur van meteoroïden te bestuderen
Beyond Bennu:hoe OSIRIS-REx wetenschappers helpt de sonische signatuur van meteoroïden te bestuderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

