
Wetenschap
Hoe lost methanol op in water?
- Waterstofbinding: Methanol (CH3OH) heeft een hydroxylgroep (-OH), waardoor het waterstofbruggen kan vormen met watermoleculen (H2O). Waterstofbinding vindt plaats wanneer een waterstofatoom dat covalent gebonden is aan een elektronegatief atoom (in dit geval zuurstof) interageert met een ander elektronegatief atoom. De gedeeltelijk positieve lading van het waterstofatoom in methanol trekt de gedeeltelijk negatieve lading van het zuurstofatoom in water aan, waardoor een binding ontstaat. Deze waterstofbruggen helpen methanolmoleculen zich te vermengen met en opgelost te blijven in water.
- Dipool-dipoolinteracties: Zowel methanol als water zijn polaire moleculen, wat betekent dat ze een gedeeltelijk positief uiteinde en een gedeeltelijk negatief uiteinde hebben vanwege verschillen in elektronegativiteit. Methanol heeft een licht positieve lading op het waterstofatoom en een licht negatieve lading op het zuurstofatoom, terwijl water een licht positieve lading heeft op de waterstofatomen en een licht negatieve lading op het zuurstofatoom. Deze gedeeltelijke ladingen creëren dipoolmomenten in beide moleculen. Het positieve uiteinde van het ene molecuul kan interageren met het negatieve uiteinde van een ander molecuul, waardoor dipool-dipoolinteracties ontstaan. Deze interacties dragen bij aan de oplosbaarheid van methanol in water.
- van der Waals Strijdkrachten: van der Waals-krachten zijn zwakke intermoleculaire krachten, waaronder Londense dispersiekrachten en permanente dipool-geïnduceerde dipoolkrachten. Londense dispersiekrachten komen voort uit de tijdelijke fluctuaties in de elektronenverdeling van moleculen. Deze fluctuaties creëren onmiddellijke dipolen, die dipolen in aangrenzende moleculen kunnen induceren. Permanente dipool-geïnduceerde dipoolkrachten treden op wanneer een permanente dipool in één molecuul een dipool induceert in een niet-polair molecuul of een polair molecuul zonder een permanente dipool. Hoewel de van der Waals-krachten zwakker zijn dan waterstofbruggen en dipool-dipool-interacties, dragen ze ook bij aan de algehele oplosbaarheid van methanol in water.
Het gecombineerde effect van waterstofbruggen, dipool-dipoolinteracties en van der Waals-krachten zorgt ervoor dat methanol in water kan oplossen en een homogeen mengsel kan vormen.
 Onderzoeksteam maakt hydrogellijmen om wonden af te dichten
Onderzoeksteam maakt hydrogellijmen om wonden af te dichten Methode onderzoekt snel het vermogen van atoomdunne materialen om waterstof te produceren
Methode onderzoekt snel het vermogen van atoomdunne materialen om waterstof te produceren Water verandert de manier waarop een op kobalt gebaseerd molecuul koolstofdioxide omzet in een veelbelovende chemische stof
Water verandert de manier waarop een op kobalt gebaseerd molecuul koolstofdioxide omzet in een veelbelovende chemische stof  Russische wetenschappers ontwikkelen technologie voor de productie van transparant aluminium
Russische wetenschappers ontwikkelen technologie voor de productie van transparant aluminium Wat bevat meer waterstofionen dan hydroxide, een base of een zuur?
Wat bevat meer waterstofionen dan hydroxide, een base of een zuur?
 The Common Snakes of Oklahoma
The Common Snakes of Oklahoma  Geef niet alleen de overheid en het bedrijfsleven de schuld van de recyclingcrisis - het begint bij ons
Geef niet alleen de overheid en het bedrijfsleven de schuld van de recyclingcrisis - het begint bij ons Hoe zijn planten en dieren van elkaar afhankelijk?
Hoe zijn planten en dieren van elkaar afhankelijk?  Hoe vrouwelijke wijsheid op oudere leeftijd olifanten helpt overleven
Hoe vrouwelijke wijsheid op oudere leeftijd olifanten helpt overleven  32 jaar later naar huis in de spookstad van Tsjernobyl
32 jaar later naar huis in de spookstad van Tsjernobyl
Hoofdlijnen
- Nieuwe AI-tool legt vast hoe eiwitten zich in context gedragen
- Factoren die het succes van translocaties van grizzlyberen beïnvloeden
- Moleculaire tags onthullen hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering
- Experiment laat zien hoe wormgastheren en het bijbehorende microbioom gezamenlijk bijdragen aan aanpassing aan het milieu
- Hoe een opkomend antiresistentie-antibioticum zich richt op het bacteriële membraan
- Onderzoek verduidelijkt de functie van de nucleaire hormoonreceptor in planten
- Wat zou er gebeuren als een cel geen Golgi-lichamen had?
- Inspanningen van de marine om walvissen te beschermen hebben beperkt effect
- Onderzoek identificeert het mechanisme achter medicijnresistentie bij malariaparasieten
- Op weg naar een ziektesnuivend apparaat dat wedijvert met de neus van een hond

- Wie gaat er nu door met het valideren van forensische wetenschappelijke disciplines?

- Nanoporiën maken draagbare massaspectrometer voor peptiden werkelijkheid
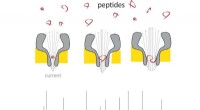
- Computermodel voor het ontwerpen van eiwitsequenties die zijn geoptimaliseerd om te binden aan medicijndoelen

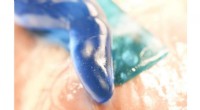
- Kleverig als het nat is:sterke kleefstof voor wondgenezing
 Hoe een model van de scheve toren van Pisa te bouwen
Hoe een model van de scheve toren van Pisa te bouwen Onderzoekers ontdekken dat pompen jong grondwater naar nieuwe diepten trekt, mogelijk met verontreinigingen op sleeptouw
Onderzoekers ontdekken dat pompen jong grondwater naar nieuwe diepten trekt, mogelijk met verontreinigingen op sleeptouw Kleine linialen om structuren op nanoschaal te meten
Kleine linialen om structuren op nanoschaal te meten Een onderzoeker uit de staat Iowa bestudeert hoe enzymen cellulose afbreken
Een onderzoeker uit de staat Iowa bestudeert hoe enzymen cellulose afbreken  Blanke Amerikanen overschatten raciale vooruitgang nog steeds enorm, studie vondsten
Blanke Amerikanen overschatten raciale vooruitgang nog steeds enorm, studie vondsten Zachte robots vereenvoudigen
Zachte robots vereenvoudigen Kan het aardse leven op Mars overleven?
Kan het aardse leven op Mars overleven? Wat is de functie van plasmiden in DNA?
Wat is de functie van plasmiden in DNA?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

