Wetenschap
Nanoporiën maken draagbare massaspectrometer voor peptiden werkelijkheid
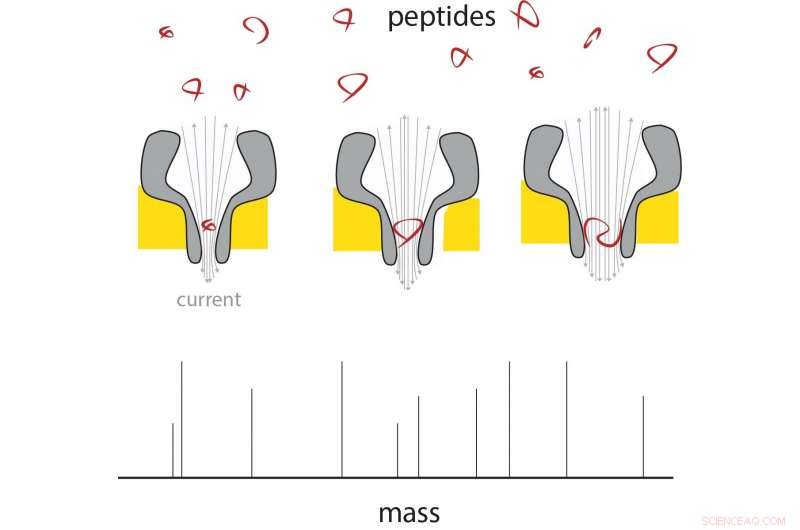
Een peptide komt het dunne uiteinde van de nanoporie binnen, en daar verandert de stroom in verhouding tot zijn massa. Door nanoporiën van verschillende grootte te gebruiken, een reeks peptidegrootten kan worden gemeten. Credit:G. Maglia / Rijksuniversiteit Groningen
Wetenschappers van de Rijksuniversiteit Groningen hebben nanoporiën ontwikkeld om de massa van peptiden direct te meten. Hoewel de resolutie moet worden verbeterd, deze proof of principle laat zien dat een goedkope en draagbare peptide massaspectrometer kan worden geconstrueerd met behulp van bestaande nanoporiëntechnologie en de gepatenteerde poriën die zijn ontwikkeld in het laboratorium van Universitair hoofddocent Chemische Biologie van de Rijksuniversiteit Groningen, Giovanni Maglia. Een artikel over deze ontdekking is gepubliceerd in: Natuurcommunicatie op 19 februari.
Massaspectrometers zijn van onschatbare waarde voor het bestuderen van eiwitten, maar ze zijn zowel omvangrijk als duur, die het gebruik ervan beperkt tot gespecialiseerde laboratoria. "Nog, de volgende revolutie in biomedische studies zal plaatsvinden in proteomics, de grootschalige analyse van eiwitten die tot expressie worden gebracht in verschillende celtypes, " zegt Maglia. Want hoewel elke cel in je lichaam hetzelfde DNA draagt, de productie van eiwitten verschilt enorm tussen celtypes. "En ook, eiwitten worden gemodificeerd nadat ze zijn geproduceerd, bijvoorbeeld door suikers toe te voegen die hun functie kunnen beïnvloeden."
Massa
Nanopore-technologie zou een manier kunnen zijn om afzonderlijke moleculen te analyseren. In eerder werk, Maglia toonde al aan dat biologische nanoporiën kunnen worden gebruikt om metabolieten te meten en om eiwitten en peptiden te identificeren. Deze poriën zijn grote eiwitstructuren, ingebouwd in een membraan. Moleculen die een porie binnenkomen of er doorheen gaan, veroorzaken een verandering in een elektrische stroom door de porie. "Een probleem bij het meten van de massa van peptiden is dat ze te snel door zelfs de kleinste biologische porie gaan om een meting te krijgen, " legt Maglia uit.
Het maken van kleinere poriën was een uitdaging. "De poriën zijn opgebouwd uit een aantal monomeren, dus we hebben in eerste instantie de interactie tussen deze monomeren aangepast, maar dat werkte niet." De observatie dat het mengen van monomeren met grotere hoeveelheden lipiden - die het membraan vormen - resulteerde in een groter percentage kleinere poriën, bracht Maglia en zijn team op het idee om de interactie tussen monomeren en lipiden te wijzigen. resulteerde inderdaad in poriën die uit een kleiner aantal monomeren bestaan, die de poriegrootte verkleinde.
Kleinste poriën ooit
Maglia was toen in staat om trechtervormige poriën te produceren die, aan hun smalle uiteinde, slechts 0,84 nanometer gemeten. "Dit zijn de kleinste biologische poriën die ooit zijn geproduceerd." De volgende uitdaging was ervoor te zorgen dat peptiden door de poriën zouden gaan, ongeacht hun chemische samenstelling. "De poriën hebben een negatieve lading, die nodig zijn voor hun goede werking, " legt Maglia uit.
De lading zorgt ervoor dat water door de porie stroomt, de peptiden meeslepen. Maar negatief geladen peptiden zouden worden afgestoten door de negatieve lading aan het dunne trechteruiteinde. Maglia wijzigde de lading door de zuurgraad van de gebruikte vloeistoffen te veranderen. "Eventueel, we hebben de juiste omstandigheden weten te vinden door de zuurgraad in te stellen op een pH van precies 3,8. Hierdoor kunnen negatief geladen peptiden door de poriën stromen terwijl er voldoende water door de poriën stroomt."
Oplossing
Metingen over nanoporiën van verschillende groottes laten zien dat de elektrische stroom lineair is met het volume van het peptide dat er doorheen gaat. Deze peptiden varieerden van 4 tot 22 aminozuren lang. Het verschil tussen de aminozuren alanine en glutamaat kon in dit systeem worden gemeten, wat betekende dat de resolutie rond de 40 Dalton lag (een maat voor de eiwitmassa). "De resolutie van conventionele massaspectrometers is veel beter, maar als we het systeem ongeveer veertig keer gevoeliger zouden kunnen krijgen, het zou al nuttig zijn in proteomics-onderzoek, ", zegt Maglia. Er zijn een aantal manieren om de resolutie te verbeteren, zegt Maglia. "We zouden de nanoporie kunnen construeren met kunstmatige aminozuren, of gebruik verschillende ionen in onze oplossingen, verminder het geluid door de temperatuur te veranderen, enzovoort."
Het nanopore-systeem heeft verschillende unique selling points:het meet afzonderlijke moleculen, de technologie zelf is al in de handel verkrijgbaar en relatief goedkoop. Verder, het nanoporiesysteem is draagbaar. En, door veel verschillende poriën in een apparaat te gebruiken, je kunt tegelijkertijd peptiden van verschillende grootte en zelfs peptide-modificaties meten. "Dit alles betekent dat een veelzijdige en goedkope massaspectrometer voor peptide-analyse haalbaar is, ", zegt Maglia. "En dat zou betekenen dat meer laboratoria het zich zouden kunnen veroorloven om zeer belangrijke proteomics-studies uit te voeren."
 Materialen voor medische jassen ondergaan strenge tests
Materialen voor medische jassen ondergaan strenge tests Geïnspireerd door de natuur, het onderzoek om een nieuw dragend materiaal te ontwikkelen
Geïnspireerd door de natuur, het onderzoek om een nieuw dragend materiaal te ontwikkelen Onderzoekers ontdekken betaalbare methode voor productie van transparante zonnecellen
Onderzoekers ontdekken betaalbare methode voor productie van transparante zonnecellen Om autocoatings te verbeteren, nieuwe tests doen meer dan krassen op het oppervlak
Om autocoatings te verbeteren, nieuwe tests doen meer dan krassen op het oppervlak Hoe het aantal representatieve deeltjes in elke stof te vinden
Hoe het aantal representatieve deeltjes in elke stof te vinden
 De bittere les van de Californische branden
De bittere les van de Californische branden UAV-vliegtuigen bieden nieuwe inzichten in de vorming van de kleinste deeltjes in het noordpoolgebied
UAV-vliegtuigen bieden nieuwe inzichten in de vorming van de kleinste deeltjes in het noordpoolgebied Terwijl gemeenschappen zich herbouwen na orkanen, onderzoek toont aan dat wetlands schade aan eigendommen aanzienlijk kunnen verminderen
Terwijl gemeenschappen zich herbouwen na orkanen, onderzoek toont aan dat wetlands schade aan eigendommen aanzienlijk kunnen verminderen Een toevallige ontmoeting met Amazon, dan is een stam bijna uitgestorven
Een toevallige ontmoeting met Amazon, dan is een stam bijna uitgestorven NASA's Aqua Satellite spot Typhoon Hatos Landfall in China
NASA's Aqua Satellite spot Typhoon Hatos Landfall in China
Hoofdlijnen
- Studie waarschuwt dat slangenschimmelziekte een wereldwijde bedreiging kan zijn
- Cytoskeleton: definitie, structuur en functie (met diagram)
- Wetenschappers ontdekken pad naar verbeterde gerstkwaliteit
- Soorten monomeren
- "Fingerprint Experiments
- Onderzoek naar superstil gemaakte DNA hints naar nieuwe manieren om cellen te herprogrammeren
- Samengestelde ogen een continu kenmerk van evolutie
- Wat is de elektrische impuls die een Axon naar beneden beweegt?
- Studie lost waarom drinken je de munchies geeft
 Luchtvervuiling verhoogt het risico op diabetes in China:studie
Luchtvervuiling verhoogt het risico op diabetes in China:studie Natuurkundigen ontdekken verborgen aspecten van elektrodynamica
Natuurkundigen ontdekken verborgen aspecten van elektrodynamica Het mysterie van de gigantische ijsbladen van Pluto oplossen
Het mysterie van de gigantische ijsbladen van Pluto oplossen Mensen geven de voorkeur aan maandelijkse betalingen in veelvouden van $ 100, zelfs als het hen geld kan kosten
Mensen geven de voorkeur aan maandelijkse betalingen in veelvouden van $ 100, zelfs als het hen geld kan kosten De Zwitserse Alpen blijven stijgen:bewijs van kosmische straling laat zien dat lift erosie overtreft
De Zwitserse Alpen blijven stijgen:bewijs van kosmische straling laat zien dat lift erosie overtreft NASA ziet een strak gewonde tyfoon Banyan
NASA ziet een strak gewonde tyfoon Banyan Onderzoek onthult het potentieel van een over het hoofd geziene oplossing voor klimaatverandering
Onderzoek onthult het potentieel van een over het hoofd geziene oplossing voor klimaatverandering Onderzoekers theoretiseren koude compressie van grafietresultaten in nieuwe superharde koolstofallotropen
Onderzoekers theoretiseren koude compressie van grafietresultaten in nieuwe superharde koolstofallotropen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | Dutch | Danish | Norway | Italian | German |

-
Wetenschap © https://nl.scienceaq.com