Wetenschap
Moleculaire tags onthullen hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering
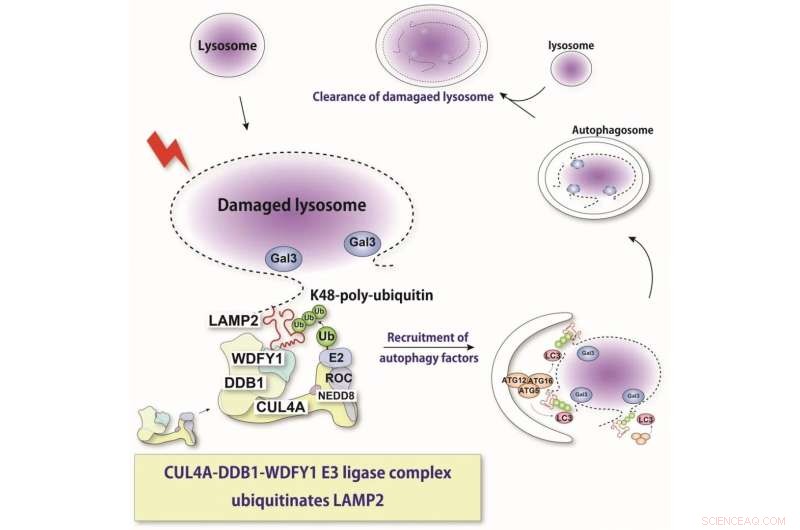
Het lysosoom is een zure intracellulaire organel die cruciaal is voor de afbraak van verschillende cellulaire componenten. Bij beschadiging van het lysosomale membraan komen lysosomale hydrolasen vrij in het cytosol en induceren stressreacties of celdood. Hier laten we zien dat een nieuw geïdentificeerd eiwitcomplex beschadigde lysosomen herkent en een substraat, LAMP2 ubiquitineert. Deze herkenning induceert selectieve autofagie. Krediet:Keisuke Tabata
Autofagie is een zelfafbraakproces dat cellen gebruiken om onnodige of beschadigde componenten te verwijderen. Er zijn verschillende vormen van autofagie, waaronder macroautofagie, een bulkdegradatiesysteem dat wordt gebruikt om materialen in het cytosol van de cel te richten op organellen die lysosomen worden genoemd voor enzymatische afbraak. Maar zelfs lysosomen zelf moeten soms worden afgebroken. Onlangs hebben onderzoekers van de Universiteit van Osaka de specifieke moleculaire details onderzocht van hoe beschadigde lysosomen worden geselecteerd en gemarkeerd voor verwijdering.
In een recent artikel gepubliceerd in Cell Reports , beschreef het team een proces genaamd lysofagie, de specifieke vorm van selectieve autofagie die verantwoordelijk is voor het opruimen van beschadigde lysosomen. Eerdere studies hebben aangetoond dat stoffen zoals toxines, lipiden en cholesterol- of uraatkristallen lysosomen kunnen scheuren. Naast het disfunctioneren van het organel, kan deze schade ook oxidatieve stress en ontsteking veroorzaken die tot ziekteontwikkeling kunnen leiden. Daarom gebruikt de cel lysofagie om dit aan te pakken. De mechanismen die bepalen hoe cellen de beschadigde lysosomen kunnen herkennen en erop kunnen richten voor afbraak, worden echter niet volledig begrepen.
"We weten uit eerdere onderzoeken dat lysosomen kunnen worden gelabeld door een specifiek enzym, SCFFBXO27, via een proces dat polyubiquitinatie wordt genoemd", zegt een van de hoofdauteurs, Hirofumi Teranishi. "Expressie van SCFFBXO27 is alleen waargenomen in hersen- en spierweefsel, dus we veronderstelden dat er nog een meer alomtegenwoordig enzym moet bestaan voor lysofagie in andere celtypen."
Het team gebruikte polystyreenkralen die waren gecoat met een reagens dat endosomale schade kon veroorzaken en vervolgens alomtegenwoordig kon worden. Vervolgens isoleerden ze de kralen door middel van centrifugatie en gebruikten ze een methode genaamd massaspectrometrie om de eiwitten die ermee geassocieerd zijn te identificeren, waardoor de lijst uiteindelijk werd teruggebracht tot 123 eiwitten.
"Met behulp van moleculaire technieken waarmee we de expressie van deze verschillende eiwitten konden uitschakelen, ontdekten we dat eiwitten genaamd CUL4A, DDB1 en WDFY1 een complex vormen dat reageert op lysosomale schade", legt Maho Hamasaki, senior auteur van de studie, uit.
Verdere karakterisering gaf aan dat dit complex bij voorkeur werkt tijdens lysofagie en de toevoeging van de ubiquitine-moleculen vergemakkelijkt. Het WDFY1-eiwit is nodig om de beschadigde lysosomen specifiek te herkennen.
"Toen vroegen we ons af welk deel van het lysosoom door dit eiwitcomplex wordt herkend", zegt Teranishi. "Tal van lysosomale eiwitten werden onderzocht, totdat we ontdekten dat LAMP2 degene is die alomtegenwoordig wordt door het CUL4A-complex."
Het team ontdekte ook dat de aanwezigheid van LAMP2 en zijn interactie met WDFY1 essentieel zijn voor het initiëren van het lysofagieproces. Over het algemeen bieden deze bevindingen kritische inzichten in de moleculaire mechanismen die centraal staan bij lysofagie. Dit kan ook helpen bij het bestrijden van ziekten waarbij dit proces ontregeld is. In de toekomst zijn de onderzoekers van plan om preciezere details te bepalen over hoe het CUL4A-complex LAMP2 herkent. + Verder verkennen
PITT-route:wetenschappers ontdekken hoe cellen het levensduurbevorderende 'recyclingsysteem' repareren
 Endotherme ladingsoverdracht bemiddelt ondiepe afstandsafhankelijke triplet-energiemigratie
Endotherme ladingsoverdracht bemiddelt ondiepe afstandsafhankelijke triplet-energiemigratie Belangrijke rol van singletzuurstof in synergetisch antimicrobieel mechanisme
Belangrijke rol van singletzuurstof in synergetisch antimicrobieel mechanisme Onderzoekers onderzoeken signaaloverdracht in eiwitten over meerdere tijdschalen
Onderzoekers onderzoeken signaaloverdracht in eiwitten over meerdere tijdschalen Wetenschapsprojecten over keukenchemie
Wetenschapsprojecten over keukenchemie  Nieuwe printtechniek gebruikt cellen en moleculen om biologische structuren na te bootsen
Nieuwe printtechniek gebruikt cellen en moleculen om biologische structuren na te bootsen
 Toegenomen smeltende sneeuw in de winter bedreigt westerse watervoorraden
Toegenomen smeltende sneeuw in de winter bedreigt westerse watervoorraden De wetenschapper Henry Hess vond uit wat voor soort apparaten
De wetenschapper Henry Hess vond uit wat voor soort apparaten  Hoe kunstmatige fotosynthese werkt
Hoe kunstmatige fotosynthese werkt  Warmste september van afgelopen maand wereldwijd gemeten:EU
Warmste september van afgelopen maand wereldwijd gemeten:EU Aardverschuiving langs de fjord van Alaska kan een tsunami veroorzaken
Aardverschuiving langs de fjord van Alaska kan een tsunami veroorzaken
Hoofdlijnen
- Wat is een positieve controle in de microbiologie?
- Bloedbad vreest race om zeldzame Australische papegaai te redden
- Een derde van alle haaiensoorten in de vinnenhandel wordt bedreigd
- Neurale opnames van wilde vleermuizen onthullen een unieke organisatie van het middenhersenengebied voor het volgen en vangen van prooien
- Verouderd DNA kan genen anders activeren
- De koala:wanneer het slim is om langzaam te zijn
- Emotionele toestanden ontdekt in vissen
- Cytokinese: wat is het? & Wat gebeurt er in planten en dierencellen?
- Radiologie werpt licht op oude vissoorten coelacanth
 NASA-NOAA-satelliet vangt tropische cycloon Ann die Queensland bedreigt
NASA-NOAA-satelliet vangt tropische cycloon Ann die Queensland bedreigt Beoordeling van de voordelen en risico's van de verwijdering van broeikasgassen op het land
Beoordeling van de voordelen en risico's van de verwijdering van broeikasgassen op het land Wetenschappers onthullen een explosief geheim verborgen onder schijnbaar betrouwbare vulkanen
Wetenschappers onthullen een explosief geheim verborgen onder schijnbaar betrouwbare vulkanen 5 Gebruik van Fermentation
5 Gebruik van Fermentation Zodra de gloeiend hete smartphonemarkt een koelere trend ziet
Zodra de gloeiend hete smartphonemarkt een koelere trend ziet Robotel:hotel in Japan bemand door robotdinosaurussen
Robotel:hotel in Japan bemand door robotdinosaurussen SpaceX Inspiration4-missie stuurt vier mensen met minimale training in een baan om de aarde
SpaceX Inspiration4-missie stuurt vier mensen met minimale training in een baan om de aarde Vloeibare honing, harige spinazie en glanzende appels:verrassende feiten over je eten
Vloeibare honing, harige spinazie en glanzende appels:verrassende feiten over je eten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com