
Wetenschap
Water efficiënter omzetten in waterstof

Credit:Universiteit Leiden
Wetenschappers vragen zich al lang af waarom het gemakkelijker is om waterstof te produceren uit water in een zure omgeving dan in een alkalische omgeving. Marc Koper komt met een verklaring:de reden is het elektrische veld aan het oppervlak van de katalysator, die groter is in een alkalische omgeving, zoals hij schrijft in een publicatie in Natuur Energie op 20 maart.
Efficiënter waterstof produceren
Marc Koper is hoogleraar Katalyse en Oppervlaktechemie en doet onderzoek naar duurzame energie, zoals het gebruik van waterstof als brandstof. "Waterstof is een schone energiebron, die we op grote schaal nog niet op een schone manier kunnen maken. Omdat we nu weten dat het elektrische veld een belangrijke rol speelt, we zijn beter in staat om de huidige systemen te finetunen om ze efficiënter te maken, ' zegt Koper.
Om water elektrochemisch om te zetten in waterstof en zuurstof, elektroden zijn nodig:een negatieve kathode en een positieve anode. "De kathode is waar waterstof wordt geproduceerd. Hiervoor is platina is de beste katalysator, tenminste in een zure omgeving. Voor de anode, waar zuurstof wordt gevormd, iridium is de beste katalysator. En dat is het zeldzaamste metaal op aarde."
Goedkoop nikkel
"In een alkalische omgeving kun je nikkel gebruiken in plaats van iridium, wat een stuk goedkoper is. Echter, de productie van waterstof is in een alkalische omgeving veel moeilijker dan in een zure omgeving. De kathode heeft een hogere spanning nodig om waterstof te produceren, wat het hele proces minder efficiënt maakt."
Zwemmen in een elektrisch veld
Marc Koper en zijn groep vermoedden dat de sterkte van het elektrische veld een rol speelt bij de snelheid van de reactie. "In een zure omgeving, er is een zwakker elektrisch veld bij de platina-elektrode bij een gegeven spanning dan in een alkalische omgeving. Een sterk elektrisch veld maakt de watermoleculen bijna "bevroren". Geladen deeltjes zoals protonen en hydroxide-ionen hebben weinig moeite met bewegen als de watermoleculen gemakkelijk meebewegen. Maar in een alkalische omgeving is het elektrische veld sterk, wat resulteert in watermoleculen die niet kunnen bewegen wanneer een geladen deeltje moet passeren. Voor deze deeltjes het is moeilijker om de platina-elektrode te bereiken. Dat is de reden waarom de reactie langzamer is dan in een zure omgeving, Koper illustreert zijn theorie.
We vroegen ons af:hoe meet je bijvoorbeeld een elektrisch veld nabij het oppervlak van de elektrode?", zegt Koper. "Collega's van de Universiteit van Alicante in Spanje hebben een speciale methode ontwikkeld om dit veld te meten, dus onze PhD Isis Ledezma-Yanez bezocht hen. De metingen kwamen overeen met ons model. Volgende, we zullen testen of het model ook klopt met andere katalysatoren dan platina."
Verder, dit onderzoek biedt Koper een nieuwe manier om systemen die waterstof maken uit water te verbeteren. “Voorafgaand aan dit onderzoek, we hebben ons alleen gericht op de bindingsenergie van de katalysator met waterstof. Dit mag niet te sterk zijn, maar het mag ook niet te zwak zijn. We weten nu dat ook de sterkte van het elektrische veld een belangrijke rol speelt. We zullen verdere experimenten uitvoeren om dit te testen, bijvoorbeeld door de samenstelling van de oplossing te variëren.
De manier waarop waterstof wordt gevormd is in een zure omgeving anders dan in een alkalische omgeving.
zure omgeving
Een proton (een deeltje met een positieve lading) beweegt door de wateroplossing naar het platinaoppervlak en bindt zich als waterstofatoom aan het platina.
Twee waterstofatomen die aan het oppervlak gebonden zijn, binden en vormen waterstof.
Alkalische omgeving
Water reageert op het platina-oppervlak, wat resulteert in een waterstofatoom gebonden aan het platina en een negatief geladen hydroxide-ion (OH - ).
Het hydroxide-ion beweegt naar de wateroplossing weg van het platina-oppervlak. Door het sterke elektrische veld en het daarbij behorende 'bevroren' water, deze stap is traag.
 10 mogelijke oplossingen voor transportvervuiling
10 mogelijke oplossingen voor transportvervuiling  Moet Ierland zijn elektriciteitscentrales van brandstof voorzien met hout dat uit Australië wordt verscheept?
Moet Ierland zijn elektriciteitscentrales van brandstof voorzien met hout dat uit Australië wordt verscheept? Bacteriën die methaan oxideren in gewone grond
Bacteriën die methaan oxideren in gewone grond Rook van bosbranden in New England is behoorlijk ernstig vanuit het perspectief van de volksgezondheid
Rook van bosbranden in New England is behoorlijk ernstig vanuit het perspectief van de volksgezondheid Milieuactivisme gaat digitaal in lockdown - maar kan het de beweging voorgoed veranderen?
Milieuactivisme gaat digitaal in lockdown - maar kan het de beweging voorgoed veranderen?
Hoofdlijnen
- Hoe een tRNA-sequentie uit een DNA-sequentie te krijgen
- Prehistorische vrouwen waren sterker dan de elite vrouwelijke atleten van vandaag
- Weefsels regenereren met moleculen die gericht zijn op genen
- Verschillen tussen codering en sjabloonstrengen
- Waarom creëren Britse wetenschappers een hybride mens-varken?
- Stamboom van Homo Sapiens blijft evolueren
- Onderzoekers bestuderen de pathobiologie van antibiotische nevenreacties
- Massive Angel Oak is getuige geweest van 500 jaar geschiedenis van South Carolina
- Wat zijn Agar Slants?
- Eiwitten choreograferen de oneindig kleine dans van levende cellen en functionele biomaterialen
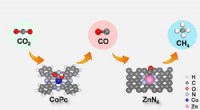
- Tandemkatalysator om de elektroreductie van kooldioxide tot methaan te verbeteren
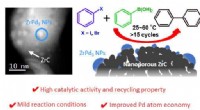
- Een gecombineerde strategie in katalysatorontwerp voor Suzuki kruiskoppelingen
- Hoe veroorzaakt verdamping afkoeling?

- Duurzaamheid en efficiëntie:de nieuwe trends in de kunststofindustrie

 Synthetisch molecuul dringt dubbelstrengs DNA binnen
Synthetisch molecuul dringt dubbelstrengs DNA binnen Onderzoek naar de dynamiek van foto-emissie
Onderzoek naar de dynamiek van foto-emissie Afbeelding:Wavemaker-maan Daphnis
Afbeelding:Wavemaker-maan Daphnis Tijdkristallen kunnen geheim zijn voor coherentie in kwantumcomputers
Tijdkristallen kunnen geheim zijn voor coherentie in kwantumcomputers Wie gelooft er in complotten? Onderzoek biedt een theorie
Wie gelooft er in complotten? Onderzoek biedt een theorie Wat als de Hoover Dam brak?
Wat als de Hoover Dam brak?  Wriemelende microtubuli helpen de koppeling van actieve defecten en kromming te begrijpen
Wriemelende microtubuli helpen de koppeling van actieve defecten en kromming te begrijpen Het grote blauw in kaart brengen:laser-geïnduceerde technologie om de exploratie van mineralen op oceanische diepten te helpen
Het grote blauw in kaart brengen:laser-geïnduceerde technologie om de exploratie van mineralen op oceanische diepten te helpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

