
Wetenschap
Hoe worden covalente bindingen bij elkaar gehouden?
In een enkele covalente binding delen twee atomen één paar elektronen. Deze elektronen worden vastgehouden in een moleculaire orbitaal, die de kernen van beide atomen omsluit en de vorm heeft van een elektronenwolk. Dubbele en drievoudige covalente bindingen delen respectievelijk twee en drie elektronenparen en hebben grotere moleculaire orbitalen die de atoomkernen nauwer omhullen.
Door elektronen te delen kunnen beide atomen edelgasconfiguraties bereiken:volledige buitenste elektronenschillen. Deze stabielere elektronenrangschikking is het resultaat van hun lagere energietoestand en geeft de gebonden atomen een grotere chemische stabiliteit.
2) Elektronegativiteit en bindingspolariteit:
De ongelijke verdeling van elektronen tussen atomen in een covalente binding creëert bindingspolariteit. Elektronegativiteit is de neiging van een atoom om elektronen naar zichzelf toe te trekken. Wanneer twee verschillende atomen een binding vormen, oefent het meer elektronegatieve atoom een grotere aantrekkingskracht uit op de gedeelde elektronen, waardoor ze dichter bij de kern worden geconcentreerd. Dit resulteert in een gedeeltelijke negatieve lading op het meer elektronegatieve atoom en een gedeeltelijke positieve lading op het minder elektronegatieve atoom.
Bondpolariteit is cruciaal bij het bepalen van de chemische eigenschappen en reactiviteit van covalente verbindingen. Het beïnvloedt de moleculaire vorm, oplosbaarheid en het chemische bindingsgedrag met andere moleculen.
Concluderend worden covalente bindingen gevormd door het delen van elektronenparen tussen atomen. Deze bindingen zijn sterker dan intermoleculaire krachten, maar zwakker dan ionische bindingen. Covalente bindingen houden individuele moleculen bij elkaar en geven ze hun vorm, eigenschappen en chemische reactiviteit. Het begrijpen van covalente bindingen is essentieel voor het begrijpen van het gedrag en de interacties van stoffen op moleculair niveau.
 Humanitaire forensische wetenschappers sporen de vermiste, identificeer de doden en troost de levenden
Humanitaire forensische wetenschappers sporen de vermiste, identificeer de doden en troost de levenden Hoe ontstaat een waterstofbrug?
Hoe ontstaat een waterstofbrug?  Waarom is hf minder stroperig dan h2o?
Waarom is hf minder stroperig dan h2o?  Bewijs dat een nieuwe cent niet van puur koper is gemaakt. Hij heeft een massa van 2,49 en een volume van 0,349 cm3?
Bewijs dat een nieuwe cent niet van puur koper is gemaakt. Hij heeft een massa van 2,49 en een volume van 0,349 cm3?  Een nieuwe vorm van cellulaire logistiek
Een nieuwe vorm van cellulaire logistiek
 Dekgewassen, compost en koolstof
Dekgewassen, compost en koolstof Hoe klimaatverandering heeft bijgedragen aan de voedselcrisis in Madagaskar
Hoe klimaatverandering heeft bijgedragen aan de voedselcrisis in Madagaskar  Identificatie van gemeenschappen die risico lopen op de gevolgen van extreme hitte
Identificatie van gemeenschappen die risico lopen op de gevolgen van extreme hitte Nieuw boek laat zien hoe je een meer overstromingsbestendige toekomst bouwt
Nieuw boek laat zien hoe je een meer overstromingsbestendige toekomst bouwt Het is tijd om na te denken over onze digitale CO2-voetafdruk
Het is tijd om na te denken over onze digitale CO2-voetafdruk
Hoofdlijnen
- Wat is de functie van DNA in jouw lichaam?
- Hoe heeft technologie de manier veranderd waarop biologen levende wezens bestuderen, om een voorbeeld te geven?
- Gaan roodharigen uitsterven?
- Nieuw onderzoek lost een van de meest verhitte geschillen over evolutionaire biologie op robuuste wijze op
- Ambitieus doel om RNA te sequencen zou de Amerikaanse economie kunnen stimuleren
- Waarom vogels over grote afstanden migreren en hoe u kunt helpen tijdens hun broedseizoen
- Cell Analogy Project Ideas
- Hoe de diversiteit van respiratoire chinonen de microbiële fysiologie beïnvloedt
- Waarom mensen muzikaal zijn
- Wetenschappers ontdekken werkingsmechanisme voor veelbelovende kankerverbinding

- Nieuw proces van bacteriën en algen kan helpen om het Britse leger koolstofarm te maken

- Ammoniakvorming bij lagere temperaturen katalyseren met ruthenium

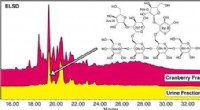
- Cranberry-oligosachariden kunnen urineweginfecties helpen voorkomen
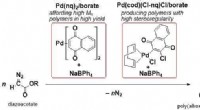
- Nieuwe op palladium gebaseerde initiatiesystemen voor C1-polymerisatie van diazoacetaten
 Wat zorgt ervoor dat twee DNA-strengen splitsen?
Wat zorgt ervoor dat twee DNA-strengen splitsen?  Wiskundige onderzoekers vinden nieuwe manieren om de wetenschap van afwegingen te verbeteren
Wiskundige onderzoekers vinden nieuwe manieren om de wetenschap van afwegingen te verbeteren Onderzoek toont aan dat fluctuerende inkomensonzekerheid kan leiden tot een neergang
Onderzoek toont aan dat fluctuerende inkomensonzekerheid kan leiden tot een neergang In gloeiende kleuren:de verspreiding van medicijndeeltjes in een forensisch laboratorium zien
In gloeiende kleuren:de verspreiding van medicijndeeltjes in een forensisch laboratorium zien Marsrover Opportunity op walkabout nabij de rand
Marsrover Opportunity op walkabout nabij de rand Top 5 oude Azteekse uitvindingen
Top 5 oude Azteekse uitvindingen  Een raketmondstuk heeft een uitgangs-tot-keeloppervlakverhouding van 4,0 en een keel van 100 cm2. De uitlaatgassen worden gegenereerd in de verbrandingskamer met een stagnatiedruk gelijk aan 4 MPa.
Een raketmondstuk heeft een uitgangs-tot-keeloppervlakverhouding van 4,0 en een keel van 100 cm2. De uitlaatgassen worden gegenereerd in de verbrandingskamer met een stagnatiedruk gelijk aan 4 MPa.  Oceanografen leggen de relatie tussen grootte en productiviteit bloot in een van 's werelds meest complexe ecosystemen
Oceanografen leggen de relatie tussen grootte en productiviteit bloot in een van 's werelds meest complexe ecosystemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

