
Wetenschap
Waarom is hf minder stroperig dan h2o?
Waterstoffluoride (HF) heeft een lagere viscositeit dan water (H2O) omdat de intermoleculaire krachten tussen HF-moleculen zwakker zijn dan de intermoleculaire krachten tussen H2O-moleculen. Dit komt omdat HF een waterstofgebonden vloeistof is, terwijl H2O een covalent gebonden vloeistof is.
In een waterstofgebonden vloeistof worden de moleculen bij elkaar gehouden door waterstofbruggen. Waterstofbruggen zijn sterke intermoleculaire krachten die ontstaan wanneer een waterstofatoom in het ene molecuul wordt gebonden aan een zeer elektronegatief atoom in een ander molecuul. In HF is het waterstofatoom gebonden aan een fluoratoom, wat een zeer elektronegatief atoom is.
In een covalent gebonden vloeistof worden de moleculen bij elkaar gehouden door covalente bindingen. Covalente bindingen zijn sterke intermoleculaire krachten die ontstaan wanneer twee atomen elektronen delen. In H2O zijn de twee waterstofatomen covalent gebonden aan het zuurstofatoom.
De waterstofbruggen in HF zijn niet zo sterk als de covalente bindingen in H2O. Dit komt omdat het fluoratoom elektronegatiever is dan het zuurstofatoom. Dit betekent dat het fluoratoom de elektronen in de waterstofbrug sterker aantrekt dan het zuurstofatoom. Dit maakt de waterstofbruggen in HF zwakker dan de waterstofbruggen in H2O.
De zwakkere waterstofbruggen in HF resulteren in een lagere viscositeit dan de sterkere waterstofbruggen in H2O. Dit betekent dat HF gemakkelijker stroomt dan H2O.
 Hele huizen weggevaagd door Irma op Bransons eiland
Hele huizen weggevaagd door Irma op Bransons eiland Nieuw rapport roept op tot onderzoek om beter te begrijpen, voorspel het lusstroomsysteem van de Golf van Mexico
Nieuw rapport roept op tot onderzoek om beter te begrijpen, voorspel het lusstroomsysteem van de Golf van Mexico Hoe bittere koude winteruitbarstingen en een opwarmende planeet de kustlijn van Lake Michigan zullen opvreten?
Hoe bittere koude winteruitbarstingen en een opwarmende planeet de kustlijn van Lake Michigan zullen opvreten? Identiteitscrisis:klimaatvernietigende wonderen die Amerikaanse parken hun naam gaven
Identiteitscrisis:klimaatvernietigende wonderen die Amerikaanse parken hun naam gaven  Meerjarig onderzoek in onderzeeër-canyon daagt leerboektheorieën over troebelheidsstromen uit
Meerjarig onderzoek in onderzeeër-canyon daagt leerboektheorieën over troebelheidsstromen uit
Hoofdlijnen
- Eetbaar diercelproject met Candy
- Welke structuren worden gebruikt voor het vangen van prooien en het veiligstellen van voedsel?
- Hoe 'moleculaire machines' genactivatie op gang brengen onthuld
- Brandende chili houdt olifanten op afstand, nieuwe studie vondsten
- Onderzoekers identificeren Ku-eiwitten als nieuwe co-sensoren van cyclische GMP-AMP-synthase
- Hoe zijn de hersenen van primaten zo groot geworden?
- Herinneren we ons slechte tijden beter dan goede?
- Wetenschappers ontdekken hoe invasieve planten een voorsprong krijgen na brand
- Hoeveel cellen moeten samen als weefsel tellen?
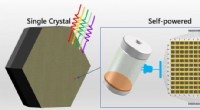
- Multi-inch monokristallijn perovskiet voor zelfaangedreven fotodetectie met geïntegreerde schakelingen gerapporteerd
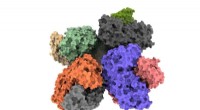
- Nieuwe inzichten in fermentatie-enzymen zullen de ecologische voetafdruk van de chemische industrie verkleinen
- De duikklokspin nabootsen om de omzetting van koolstof in brandstoffen te verbeteren

- Botproteomics kunnen onthullen hoe lang een lijk onder water is geweest

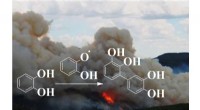
- Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden
 Op schoen gemonteerde laser om mensen te ontdooien met Parkinson-scoops € 1 miljoen prijs
Op schoen gemonteerde laser om mensen te ontdooien met Parkinson-scoops € 1 miljoen prijs Eerste directe observatie van georiënteerde hechting in nanokristalgroei
Eerste directe observatie van georiënteerde hechting in nanokristalgroei 7 geheime grotten die we graag binnen zien
7 geheime grotten die we graag binnen zien  Een kaart die een gat van 500 miljoen jaar in de geschiedenis van de aarde opvult
Een kaart die een gat van 500 miljoen jaar in de geschiedenis van de aarde opvult Uit onderzoek blijkt één reden waarom duiven zo zelden crashen
Uit onderzoek blijkt één reden waarom duiven zo zelden crashen  GPM Satellite toont krachtige supertyfoon Yutu die Noordelijke Marianen treft
GPM Satellite toont krachtige supertyfoon Yutu die Noordelijke Marianen treft Nanobuis-elektroden verbeteren zonnecellen, tegen lage kosten kan opleveren, efficiënt alternatief
Nanobuis-elektroden verbeteren zonnecellen, tegen lage kosten kan opleveren, efficiënt alternatief Met deze designerkleding kunnen gebruikers elektronica aanzetten en bacteriën afweren
Met deze designerkleding kunnen gebruikers elektronica aanzetten en bacteriën afweren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

