
Wetenschap
Waarom hebben de elementen in groep 16 vergelijkbare chemische eigenschappen?
De elementen in groep 16 hebben allemaal zes valentie-elektronen. Dit betekent dat ze allemaal covalente bindingen kunnen vormen met andere atomen door hun valentie-elektronen te delen. Ze kunnen ook ionische bindingen vormen door elektronen te verliezen of te winnen.
De gelijkenis in het aantal valentie-elektronen tussen de elementen in groep 16 geeft ze vergelijkbare chemische eigenschappen, zoals:
* Ze zijn allemaal niet-metaalachtig.
* Ze hebben allemaal een lage elektronegativiteit.
* Ze vormen allemaal covalente bindingen met andere atomen.
* Ze kunnen allemaal ionische bindingen vormen door elektronen te verliezen of te winnen.
* Ze reageren allemaal met zuurstof en vormen oxiden.
* Ze reageren allemaal met waterstof en vormen hydriden.
De elementen in groep 16 zijn:
* Zuurstof (O)
* Zwavel (S)
* Seleen (Se)
* Tellurium (Te)
* Polonium (Po)
Deze elementen worden allemaal gebruikt in verschillende toepassingen, zoals:
* Zuurstof wordt gebruikt bij de productie van staal, kunststoffen en kunstmest.
* Zwavel wordt gebruikt bij de productie van zwavelzuur, dat in verschillende industrieën wordt gebruikt, zoals de kunstmestindustrie en de aardolie-industrie.
* Selenium wordt gebruikt bij de productie van halfgeleiders en zonnecellen.
* Tellurium wordt gebruikt bij de productie van halfgeleiders en legeringen.
* Polonium wordt gebruikt als bron van alfadeeltjes in kerncentrales en in medische toepassingen.
 Reactie van natriumhydroxide tegen zwavelzuur?
Reactie van natriumhydroxide tegen zwavelzuur?  Extreme kou kan de dynamiek van herpesvirusinfecties onthullen
Extreme kou kan de dynamiek van herpesvirusinfecties onthullen Externe structuur kan de functie van enzymen beïnvloeden
Externe structuur kan de functie van enzymen beïnvloeden Licht-oogstende katalysatoren voor nanodeeltjes zijn veelbelovend in zoektocht naar hernieuwbare brandstoffen op basis van koolstof
Licht-oogstende katalysatoren voor nanodeeltjes zijn veelbelovend in zoektocht naar hernieuwbare brandstoffen op basis van koolstof Hoe Vmax Lineweaver
Hoe Vmax Lineweaver
 Koolstofcompensatie:een bloeiende markt of greenwashing?
Koolstofcompensatie:een bloeiende markt of greenwashing? Ambtenaren:een dam in Oregon kan falen bij een grote aardbeving
Ambtenaren:een dam in Oregon kan falen bij een grote aardbeving Toenemende orkaanintensiteit rond Bermuda gekoppeld aan stijgende oceaantemperaturen
Toenemende orkaanintensiteit rond Bermuda gekoppeld aan stijgende oceaantemperaturen Nieuwe gegevens onthullen de betekenis van de superstorm in Perth
Nieuwe gegevens onthullen de betekenis van de superstorm in Perth Nieuw model werpt licht op dag-/nachtcyclus in de oceaan
Nieuw model werpt licht op dag-/nachtcyclus in de oceaan
Hoofdlijnen
- Door te bezuinigen op milieu-uitgaven, de overheid snijdt kansen
- Tussen geometrie en biologie:hoe waarom is het aantal soorten afhankelijk van het gebied?
- Lood visgerei kan een bedreiging vormen voor de populaties van duikers
- In sommige delen van de VS daalt het aantal wilde kalkoenen; de belangrijkste reden kan het verlies van leefgebied zijn
- Onderzoek naar een moleculair mechanisme dat thermofiele schimmelaanpassing aan temperatuurverandering vergemakkelijkt
- Hoe delen van een plant met elkaar kunnen 'praten' ten bate van het geheel
- Sociale wespen laten zien hoe grotere hersenen voor complexe cognitie zorgen
- Onderzoek met bacteriën brengt wetenschappers een stap dichter bij het maken van kunstmatige cellen met levensechte functionaliteit
- Wat zijn de stadia van de meiose?
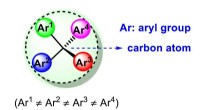
- Wetenschappers hebben nieuwe manier gevonden om chirale tetraarylmethaan te synthetiseren
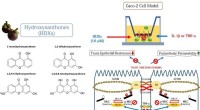
- Replicatie van extract van mangosteenschil als behandeling voor darmontsteking bij mens en dier
- Nieuwe robotsensortechnologie kan reproductieve gezondheidsproblemen in realtime diagnosticeren

- Het aangaan van een 100 jaar oude uitdaging zou de weg kunnen banen naar digitale aroma's

- Nieuw katalysatormateriaal produceert overvloedige goedkope waterstof

 Waarom kikkers gered moeten worden
Waarom kikkers gered moeten worden  Een gouden draad door het labyrint van nanomaterialen
Een gouden draad door het labyrint van nanomaterialen Heeft geweld onze gezichten gevormd?
Heeft geweld onze gezichten gevormd?  Wat is de gemiddelde luchtsnelheid van een onbeladen mus?
Wat is de gemiddelde luchtsnelheid van een onbeladen mus?  Hoe testosteron het zingen bij kanaries reguleert
Hoe testosteron het zingen bij kanaries reguleert  Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings
Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings Nanofabriek belooft geweldige dingen voor grafeenwetenschap
Nanofabriek belooft geweldige dingen voor grafeenwetenschap Wetenschapsprojecten over slangen
Wetenschapsprojecten over slangen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

