
Wetenschap
Welke kracht houdt atomen bij elkaar in verbindingen?
* Covalente bindingen worden gevormd wanneer twee of meer atomen een of meer elektronenparen delen. Hierdoor ontstaat er een sterke aantrekkingskracht tussen de atomen, omdat ze een wederzijdse interesse in de elektronen delen. Covalente bindingen zijn het sterkste type chemische binding.
* Ionische bindingen worden gevormd wanneer een of meer elektronen van het ene atoom naar het andere worden overgedragen. Hierdoor ontstaat een positief en negatief geladen ion, die tot elkaar aangetrokken worden. Ionische bindingen zijn niet zo sterk als covalente bindingen, maar ze zijn nog steeds erg sterk.
* Metaalbindingen worden gevormd wanneer de atomen in een metaal een zee van elektronen delen. Hierdoor ontstaat er een sterke aantrekkingskracht tussen de atomen, omdat ze allemaal worden aangetrokken door dezelfde pool van elektronen. Metaalbindingen zijn niet zo sterk als covalente of ionische bindingen, maar ze zijn nog steeds sterk genoeg om metalen bij elkaar te houden.
Het type chemische binding dat tussen twee atomen ontstaat, hangt af van de elektronegativiteit van de atomen. Elektronegativiteit is een maatstaf voor het vermogen van een atoom om elektronen aan te trekken. Hoe groter het verschil in elektronegativiteit tussen twee atomen, hoe waarschijnlijker het is dat er een ionische binding ontstaat. Als het elektronegativiteitsverschil klein is, zal er waarschijnlijk een covalente binding ontstaan.
 Wat zijn feiten over klodders in een flessenwetenschappelijk experiment?
Wat zijn feiten over klodders in een flessenwetenschappelijk experiment?  Welke kleur heeft een waterige oplossing van Ag?
Welke kleur heeft een waterige oplossing van Ag?  Nieuwe sensor om atmosferische aerosolen en stikstofdioxide tegelijkertijd te meten
Nieuwe sensor om atmosferische aerosolen en stikstofdioxide tegelijkertijd te meten Huidslijm van Afrikaanse meervallen levert een veelbelovende antibacteriële verbinding op
Huidslijm van Afrikaanse meervallen levert een veelbelovende antibacteriële verbinding op  Rekbare supercondensatoren om de draagbare apparaten van morgen van stroom te voorzien
Rekbare supercondensatoren om de draagbare apparaten van morgen van stroom te voorzien
 Uit onderzoek blijkt dat de omstandigheden op het landoppervlak van invloed kunnen zijn op convectieve systemen op mesoschaal terwijl ze in beweging zijn
Uit onderzoek blijkt dat de omstandigheden op het landoppervlak van invloed kunnen zijn op convectieve systemen op mesoschaal terwijl ze in beweging zijn Antarctica levert de wereld minstens 276 miljard dollar per jaar aan economische voordelen op, zo blijkt uit nieuw onderzoek
Antarctica levert de wereld minstens 276 miljard dollar per jaar aan economische voordelen op, zo blijkt uit nieuw onderzoek  NASA meet tropische cyclonen Vayus-temperatuur
NASA meet tropische cyclonen Vayus-temperatuur Een snel einde aan olie zal het klimaat niet redden
Een snel einde aan olie zal het klimaat niet redden Vergelijk en contrasteer kunstmatige en natuurlijke selectie
Vergelijk en contrasteer kunstmatige en natuurlijke selectie
Hoofdlijnen
- Voedselveiligheid, kwaliteitsbeoordeling vat het duurzame behoud van zeevruchten samen om verspilling en verliezen te minimaliseren
- Wat is een bijtmiddel in de microbiologie?
- Uitsterven amfibieën leidt tot malariapiek in Latijns-Amerika
- Meloenen moleculair pantser:nieuwe inzichten in gewasbescherming
- Het transcriptoom van een schadelijk onkruid samenstellen:nieuwe bronnen om te bestuderen hoe planten binnendringen
- Welke van de volgende uitspraken beschrijft het beste wat onderzoekers als eerste moeten doen om DNA te manipuleren?
- De herfst is de beste tijd om nestkasten voor kerkuilen schoon te maken
- Hoe klonen werkt
- Niet-duurzame voedselsystemen:kunnen we de huidige trends omkeren?
- Nieuwe fotonische vloeibare kristallen kunnen leiden tot displays van de volgende generatie

- Onzichtbare organische light-emitting diodes bereiken nieuw wereldrecord

- Video:Wat is een elektron?

- Slakkenlijm onthult aanwijzingen voor het maken van betere medische lijmen
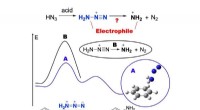
- Chemici bewijzen het mechanisme van directe aminering uit benzeen
 Gepolariseerde microscopietechniek toont nieuwe details van hoe eiwitten zijn gerangschikt
Gepolariseerde microscopietechniek toont nieuwe details van hoe eiwitten zijn gerangschikt  Walging drijft sommige religieuze gedachten en gevoelens - nieuw onderzoek suggereert
Walging drijft sommige religieuze gedachten en gevoelens - nieuw onderzoek suggereert Langzaam afgekoeld DNA transformeert ongeordende nanodeeltjes in geordend kristal
Langzaam afgekoeld DNA transformeert ongeordende nanodeeltjes in geordend kristal Patenttalk toont Samsungs ideeën voor toekomstig telefoonontwerp
Patenttalk toont Samsungs ideeën voor toekomstig telefoonontwerp Nanodeeltjes kunnen een nieuwe manier zijn om polio wereldwijd uit te roeien
Nanodeeltjes kunnen een nieuwe manier zijn om polio wereldwijd uit te roeien Opsporen van storingen in het elektriciteitsnet
Opsporen van storingen in het elektriciteitsnet De eerste orkaan van 2021 kwam vroeg. Het kan een teken zijn van wat komen gaat
De eerste orkaan van 2021 kwam vroeg. Het kan een teken zijn van wat komen gaat Internationale samenwerking onthult Chinese koolstofbalans
Internationale samenwerking onthult Chinese koolstofbalans
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

