
Wetenschap
Externe structuur kan de functie van enzymen beïnvloeden

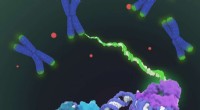
Markus Piotrowski voor een collage; een afbeelding van nitrilasehelices genomen met een elektronenmicroscoop wordt onderaan getoond, een reconstructie van de spiraal (berekend op basis van het elektronenmicroscoopbeeld) rechts, en het model van een enkel nitrilase-enzym aan de linkerkant. Krediet:RUB, Marquard
Een onderzoeksteam van de Ruhr-Universität Bochum (RUB) en uit Zuid-Afrika heeft twee enzymen geanalyseerd met identieke substraatbindende pockets die toch verschillende substraten omzetten. In het proces, het bleek dat veranderingen aan het enzymoppervlak de substraatspecificiteit beïnvloeden door te wijzigen hoe dicht het erin zit. Deze bevindingen kunnen de weg vrijmaken voor het manipuleren van de enzymfunctie. De onderzoekers publiceerden hun rapport in het tijdschrift Communicatiebiologie op 2 november 2018.
De onderzoekers ontdekten dat plantenenzymen, zogenaamde nitrilasen, lijken heel erg op elkaar. Stuk voor stuk konden ze hun onderdelen vervangen. "We hebben dus ontdekt dat door slechts één enkel onderdeel op het oppervlak te verwisselen, we zouden het ene enzym het substraat van een ander enzym kunnen laten omzetten, " legt universitair hoofddocent Dr. Markus Piotrowski van de afdeling Moleculaire Genetica en Fysiologie van Planten bij RUB uit.
De onderzoekers gebruikten elektronenmicroscopie om te analyseren waarom een wijziging van het oppervlak de substraatbinding binnenin kan beïnvloeden. De geanalyseerde nitrilasen vormen grotere helices die groot genoeg zijn om onder een elektronenmicroscoop zichtbaar te worden gemaakt. "We konden dus zien dat veranderingen aan het oppervlak ertoe leidden dat enzymmoleculen in de helix min of meer dicht opeengepakt waren, " zegt Piotrowski. "Dit, beurtelings, vermoedelijk zorgt ervoor dat de substraatbindingsplaats min of meer stevig wordt samengedrukt." In zijn strakker samengedrukte toestand, de bindingszak is niet langer toegankelijk voor grotere substraatmoleculen.
Voor onderzoekers, nitrilasen vormen een model van de evolutie van enzymen, maar ze worden ook ingezet in de chemische en farmaceutische industrie als biokatalysatoren. Daten, experimenten die gericht zijn op het modificeren van deze enzymen door hun substraatbindingsplaats te veranderen, zijn meestal niet succesvol geweest. "Onze resultaten hebben aangetoond dat de quaternaire structuur, namelijk het aantal en de rangschikking van individuele enzymmoleculen, in aanmerking moet worden genomen, " zegt Markus Piotrowski. Dienovereenkomstig, gerichte modificaties van de enzymfunctie kunnen worden bereikt zonder veranderingen aan het enzym zelf aan te brengen, maar alleen door het te comprimeren tot nitrilasehelices met verschillende dichtheden.
Hoofdlijnen
- Hoe zijn bacteriën en plantencellen gelijk?
- Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van enzymactiviteit?
- Wetenschappers hebben ontdekt welke genen onkambaar haarsyndroom veroorzaken
- Great Basin zaadstudie-experiment richt zich op herstel van weidegronden
- Robuuste kaken en verpletterende beten zorgen ervoor dat zeeotters hun dieet kunnen specialiseren
- Onderzoeker bestudeert vogels die alle paringsregels overtreden
- Olifantenstroperij in Afrika neemt af, maar ivoorvangsten nemen toe:studie
- Gekooide blauwe mosselen als milieudetectives
- Waarvan zijn nucleïnezuren gemaakt?
- Hoe scheikundigen moleculaire assemblagelijnen bouwen

- Hoe schadelijk chloorfluorkoolwaterstoffen de ozonlaag?

- Een computermodel heeft geleerd prostaatkanker op te sporen

- Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
- Neutronen gebruiken om te bestuderen hoe resistente bacteriën evolueren

 Hoe MBH naar Tons
Hoe MBH naar Tons Tijdbesparende simulatie van het afpellen van grafeenvellen
Tijdbesparende simulatie van het afpellen van grafeenvellen Hoe zelfs een geautomatiseerd, verbonden voertuig kan de veiligheid verbeteren en energie besparen in het verkeer
Hoe zelfs een geautomatiseerd, verbonden voertuig kan de veiligheid verbeteren en energie besparen in het verkeer Emissies van fossiele brandstoffen volgen met koolstof-14
Emissies van fossiele brandstoffen volgen met koolstof-14 Onderzoekers laten zien hoe grafeen-metaal-interfaces elektronen beïnvloeden
Onderzoekers laten zien hoe grafeen-metaal-interfaces elektronen beïnvloeden Waarom de Chinese wetenschap zo geheimzinnig lijkt - en hoe deze op het punt staat te veranderen
Waarom de Chinese wetenschap zo geheimzinnig lijkt - en hoe deze op het punt staat te veranderen Onderzoek naar landing Schiaparelli afgerond
Onderzoek naar landing Schiaparelli afgerond Sedimentkernen van Dogger Littoral suggereren dat Dogger Island de oude tsunami heeft overleefd
Sedimentkernen van Dogger Littoral suggereren dat Dogger Island de oude tsunami heeft overleefd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com


