
Wetenschap
Wat is meer reactieve sp2- of sp3-koolstof?
Sp2 Koolstoffen:
- sp2-koolstofatomen hebben een trigonale vlakke geometrie met drie elektronenparen gerangschikt in een driehoekige vorm rond het koolstofatoom.
- Deze koolstofatomen hebben één ongehybridiseerde p-orbitaal loodrecht op het vlak van de drie sp2-orbitalen, wat meer elektronendelokalisatie en verhoogde reactiviteit mogelijk maakt.
- Door de aanwezigheid van de p-orbitaal kunnen sp2-koolstofatomen deelnemen aan verschillende reacties, zoals elektrofiele toevoegingen, nucleofiele substituties en cycloaddities.
- Voorbeelden van sp2-koolstofatomen zijn onder meer die gevonden in alkenen, alkynen en aromatische verbindingen.
Sp3 Koolstoffen:
- sp3-koolstofatomen hebben een tetraëdrische geometrie met vier elektronenparen gerangschikt in een driedimensionale tetraëdrische vorm rond het koolstofatoom.
- Alle vier de elektronenparen zijn gehybridiseerd, wat resulteert in vier gelijkwaardige sp3-orbitalen die naar de hoeken van een tetraëder wijzen.
- De tetraëdrische opstelling van sp3-koolstofatomen maakt ze minder reactief omdat de elektronen meer gelokaliseerd zijn en minder toegankelijk voor reacties.
- sp3-koolstofatomen worden doorgaans aangetroffen in verzadigde verbindingen zoals alkanen en cycloalkanen, waarbij de koolstofatomen gebonden zijn aan vier andere atomen.
Samenvattend zijn sp2-koolstofatomen reactiever dan sp3-koolstofatomen vanwege de aanwezigheid van de ongehybridiseerde p-orbitaal, die een grotere elektronendelokalisatie mogelijk maakt en verschillende chemische reacties vergemakkelijkt.
 Bossen herstellen met 1 boom tegelijk, om het klimaat te helpen herstellen
Bossen herstellen met 1 boom tegelijk, om het klimaat te helpen herstellen Hoe we meer uit onze bossen kunnen halen
Hoe we meer uit onze bossen kunnen halen Opwarmende wateren in de westelijke tropische Stille Oceaan kunnen de West-Antarctische ijskap aantasten
Opwarmende wateren in de westelijke tropische Stille Oceaan kunnen de West-Antarctische ijskap aantasten Tienvoudige CO2-reductie nodig om klimaatdoelstelling Parijs te halen
Tienvoudige CO2-reductie nodig om klimaatdoelstelling Parijs te halen Aardbevingen en uitbarstingen
Aardbevingen en uitbarstingen
Hoofdlijnen
- Onderzoekers ontdekken 'wondermicroben' die verklaren hoe cellen complex werden
- Oncogene: wat is het? & Hoe beïnvloedt het de celcyclus?
- Hoe we een opmerkelijke vlucht van een kleine zeevogelsoort naar een tyfoon hebben gevolgd
- Nieuw onderzoek laat zien hoe wetenschappers sociale media gebruiken
- Hoe genoctrooien werken
- Waarom krijgen demonen de schuld van slaapverlamming?
- Kan boos worden goed voor je zijn?
- Hoe cellen hun afval afvoeren
- Wat zit er in een naam? In sommige gevallen een langere levensduur
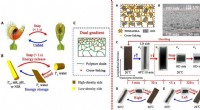
- Ontwikkeling van een ultrasnel biomimetisch snapping hydrogelmateriaal met twee gradiënten
- Groene eiwitten maken uit de lucht

- De breuktaaiheid van het materiaal voor vliegtuigbouw wordt 1,5 keer verhoogd

- Onderzoekers ontwikkelen een nieuw raman-spectroscopieplatform om IDP's in verdunde oplossing te karakteriseren

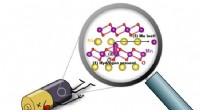
- Op weg naar een betere batterij:wetenschappers ontdekken de bron van degradatie in natriumbatterijen
 Stappen van DNA Transcriptie
Stappen van DNA Transcriptie Siliciumqubits plus licht zorgen voor nieuwe kwantumcomputercapaciteit
Siliciumqubits plus licht zorgen voor nieuwe kwantumcomputercapaciteit Grote transnationale bedrijven spelen een cruciale rol in het wereldwijde beheer van natuurlijke hulpbronnen
Grote transnationale bedrijven spelen een cruciale rol in het wereldwijde beheer van natuurlijke hulpbronnen Grafeen-origami opent nieuwe spintronica-functies
Grafeen-origami opent nieuwe spintronica-functies Lessen op groene schoolpleinen komen ten goede aan kleuters, vooral meisjes
Lessen op groene schoolpleinen komen ten goede aan kleuters, vooral meisjes Kortere uren stimuleren de verkoop in het overwerkte Japan:Microsoft
Kortere uren stimuleren de verkoop in het overwerkte Japan:Microsoft Wat is de molaire massa van B10H14?
Wat is de molaire massa van B10H14?  Vrouwen die nauwe verkiezingen verliezen, hebben net zoveel kans om opnieuw deel te nemen als mannen
Vrouwen die nauwe verkiezingen verliezen, hebben net zoveel kans om opnieuw deel te nemen als mannen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

