
Wetenschap
Welke invloed heeft temperatuur op waterstofperoxide?
* Verhoogde temperatuur:
Wanneer de temperatuur wordt verhoogd, neemt de ontledingssnelheid van waterstofperoxide toe. Dit komt omdat de hogere temperatuur meer energie aan de moleculen levert, waardoor ze de activeringsenergiebarrière kunnen overwinnen en kunnen reageren. Als gevolg hiervan wordt de snelheid van de ontleding van waterstofperoxide sneller bij hogere temperaturen.
* Verlaagde temperatuur:
Omgekeerd, wanneer de temperatuur wordt verlaagd, neemt de ontledingssnelheid van waterstofperoxide af. Dit komt omdat de lagere temperatuur minder energie aan de moleculen levert, waardoor het voor hen moeilijker wordt om de activeringsenergiebarrière te overwinnen en te reageren. Daarom wordt de snelheid van de ontleding van waterstofperoxide langzamer bij lagere temperaturen.
Het verband tussen temperatuur en de ontledingssnelheid van waterstofperoxide kan worden beschreven met de Arrhenius-vergelijking:
```
k =Ae^(-Ea/RT)
```
Waar:
- k is de snelheidsconstante van de reactie
- A is de pre-exponentiële factor
- Ea is de activeringsenergie van de reactie
- R is de ideale gasconstante
- T is de absolute temperatuur
Deze vergelijking laat zien dat de snelheidsconstante (k) van de reactie exponentieel gerelateerd is aan de temperatuur (T). Naarmate de temperatuur stijgt, neemt de snelheidsconstante toe, en omgekeerd.
Samenvattend heeft de temperatuur een significant effect op de ontledingssnelheid van waterstofperoxide. Hogere temperaturen versnellen het ontledingsproces, terwijl lagere temperaturen het vertragen. Dit gedrag is consistent met de principes van de chemische kinetiek en de Arrhenius-vergelijking.
 Studie suggereert een grote toename van Arctische neerslag in de komende eeuw, veel van het regen
Studie suggereert een grote toename van Arctische neerslag in de komende eeuw, veel van het regen Hoe rookvervuiling te genezen uit fabrieken
Hoe rookvervuiling te genezen uit fabrieken Onderzoekers beoordelen omgevingsomstandigheden die leiden tot schadelijke algenbloei
Onderzoekers beoordelen omgevingsomstandigheden die leiden tot schadelijke algenbloei Satellietgegevens tonen de ernst van de droogtezomers in 2018 en 2019
Satellietgegevens tonen de ernst van de droogtezomers in 2018 en 2019 Een krabbenperspectief van opkomend tij in een veranderende wereld
Een krabbenperspectief van opkomend tij in een veranderende wereld
Hoofdlijnen
- Kunnen sociale interacties de verspreiding van ziekten beïnvloeden?
- In een warmere wereld is de helft van alle soorten in beweging. Waar gaan ze heen?
- Wat is een vetzuur? | Hoe dingen werken
- Het verhaal van de paarse tomaat – en waarom het succes ervan een overwinning is voor genetisch gemodificeerd voedsel
- We volgen al 18 jaar vogels in een klein Nigeriaans bos - wat we hebben gevonden en waarom het ertoe doet
- Verstikt, gewurgd en verdronken. Hoe plastic zakken met ballonnen zeedieren doden
- Hoe veehouderijsystemen fungeren als reservoir voor antimicrobieel resistente bacteriën
- Wat is het proces waarbij DNA zichzelf reproduceert?
- Wat is recombinatie?
- Superresolutiemicroscoop onthult geheimen van dodelijk Nipah-virus

- Nieuwe antibacteriële geneesmiddelen ontwikkeld aan de Universiteit van Oost-Finland
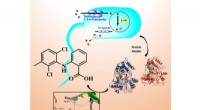
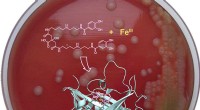
- Onderzoekers rapporteren strategie om te voorkomen dat de miltvuurbacterie ijzer absorbeert
- Draagbare sensor bewaakt de gezondheid, medicijnen toedient met speeksel en tranen

- Potentieel nieuw zonnescherm is koraalveilig en biedt meer UVB/UVA-bescherming

 Gebruik voor petroleumcokes
Gebruik voor petroleumcokes Welk soort gas komt er uit je bodem?
Welk soort gas komt er uit je bodem?  Op zoek naar leven op Enceladus:welke vragen moeten we stellen?
Op zoek naar leven op Enceladus:welke vragen moeten we stellen?  Hoe overleven reuzenpanda's?
Hoe overleven reuzenpanda's?  Hoe een Dam Craft te bouwen met Popsicle Sticks
Hoe een Dam Craft te bouwen met Popsicle Sticks Universiteit gericht in Hongarije opent in Wenen
Universiteit gericht in Hongarije opent in Wenen Kan een stromend vloeistofachtig materiaal zijn structurele orde handhaven zoals kristallen?
Kan een stromend vloeistofachtig materiaal zijn structurele orde handhaven zoals kristallen? Schone technologie om chitosan met laag molecuulgewicht te maken
Schone technologie om chitosan met laag molecuulgewicht te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

