
Wetenschap
Wat kenmerkt een zuur-base-reactie van Arrhenius?
1. Het zuur doneert een proton (H+) aan de base.
2. De base accepteert het proton uit het zuur.
3. Het zout wordt gevormd door de combinatie van het zure anion en het basische kation.
4. Water wordt gevormd door de combinatie van het waterstofion uit het zuur en het hydroxide-ion uit de base.
Hier is een algemene vergelijking voor een zuur-base-reactie van Arrhenius:
$$ \text{Zuur} + \text{Basis} \longrightarrow \text{Zout} + \text{Water} $$
Bijvoorbeeld Wanneer zoutzuur (HCl) en natriumhydroxide (NaOH) reageren, vindt de volgende reactie plaats:
$$ HCl + NaOH \longrightarrow NaCl + H_2O $$
Bij deze reactie is HCl het zuur, NaOH de base, NaCl het zout en H2O het water.
Zuur-base-reacties van Arrhenius zijn belangrijk in veel chemische processen, waaronder:
- Spijsvertering :De maag produceert zoutzuur om voedsel af te breken.
- Neutralisatie :Zuren en basen kunnen worden gebruikt om elkaar te neutraliseren, wat belangrijk is in veel industriële en ecologische processen.
- Batterijwerking: Veel batterijen gebruiken zuur-base-reacties om elektriciteit op te wekken.
Zuur-base-reacties van Arrhenius zijn slechts één type chemische reactie. Er zijn nog veel meer soorten reacties, waaronder:
- Verbrandingsreacties
- Ontbindingsreacties
- Redoxreacties
 De producten in een ontledingsreactie?
De producten in een ontledingsreactie?  Realtime dekking van de binnenkant van de hersenen mogelijk gemaakt
Realtime dekking van de binnenkant van de hersenen mogelijk gemaakt Waarom het faseveranderingsmateriaal ijzer-tellurium het beste elektriciteit geleidt in zijn ongeordende amorfe fase
Waarom het faseveranderingsmateriaal ijzer-tellurium het beste elektriciteit geleidt in zijn ongeordende amorfe fase  Is uw machine learning-trainingsset bevooroordeeld? Hoe nieuwe medicijnen te ontwikkelen op basis van samengevoegde datasets
Is uw machine learning-trainingsset bevooroordeeld? Hoe nieuwe medicijnen te ontwikkelen op basis van samengevoegde datasets Waarom zijn ionische verbindingen harde kristallijne vaste stoffen?
Waarom zijn ionische verbindingen harde kristallijne vaste stoffen?
 UTA civiel ingenieursboek illustreert de kracht van gerecycled plastic bij het versterken van wegen
UTA civiel ingenieursboek illustreert de kracht van gerecycled plastic bij het versterken van wegen Hoe vrienden te maken met een eekhoorn
Hoe vrienden te maken met een eekhoorn  Verhoogde niveaus van kwik bij vrouwen in de vruchtbare leeftijd in landen in de Stille Oceaan
Verhoogde niveaus van kwik bij vrouwen in de vruchtbare leeftijd in landen in de Stille Oceaan Australiër breekt wereldrecord met Everest-top
Australiër breekt wereldrecord met Everest-top Getroffen door overstromingen, Amerikaanse riviergemeenschappen proberen nieuwe remedies
Getroffen door overstromingen, Amerikaanse riviergemeenschappen proberen nieuwe remedies
Hoofdlijnen
- Nieuwe analyse van oude vissen kan verklaren hoe de schouder is geëvolueerd
- Hoe een Antarctische worm antivries maakt en wat dat met klimaatverandering te maken heeft
- Hoe een ziektekiem een virus vangt
- Hoe defecten in één gen drie verschillende en verwoestende ziekten bij de mens veroorzaken
- Landbouw zorgt voor meer dan 90% van de tropische ontbossing
- Verandering in de gencode kan verklaren hoe menselijke voorouders staarten verloren
- Klein maar krachtig:plankton behoort tot de krachtigste wezens op aarde
- Wie is je vader? De geschiedenis van vaderschapstesten
- Hoe het coronavirus interageert met cellen
- Innovatie kan de detectie van COVID-19-infecties verbeteren

- Ervoor zorgen dat broccolispruiten hun kankerbestrijdende stoffen behouden

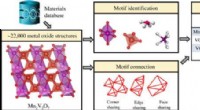
- Structuurmotiefgericht leerkader voor anorganische kristallijne systemen
- Natuurkundigen ontdekken mechanisme voor vorming van bloedplaatjes
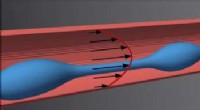
- Kleine magnetische deeltjes zorgen ervoor dat nieuw materiaal kan buigen, twist, en grijp

 Waarom het geheime wetenschappelijke voorstel van de EPA de volksgezondheidsexperts alarmeert
Waarom het geheime wetenschappelijke voorstel van de EPA de volksgezondheidsexperts alarmeert Eerste magneten voor FAIR getest bij CERN
Eerste magneten voor FAIR getest bij CERN NASA-missie onthult een dans van elektronen in de ruimte
NASA-missie onthult een dans van elektronen in de ruimte Wie is verantwoordelijk voor zwerfvuil op zee?
Wie is verantwoordelijk voor zwerfvuil op zee? Vraag van $100 miljoen:Waar is breedband in de VS?
Vraag van $100 miljoen:Waar is breedband in de VS?  Welk verdund zuur wordt aan een monster kalksteen toegevoegd? De rots bruist, welke chemische stof bevat dit?
Welk verdund zuur wordt aan een monster kalksteen toegevoegd? De rots bruist, welke chemische stof bevat dit?  Hoe zorgen we ervoor dat leerlingen uit kansarme milieus vertrouwen krijgen in school?
Hoe zorgen we ervoor dat leerlingen uit kansarme milieus vertrouwen krijgen in school?  Visualisatie van de ingebedde, gedraaide interfaces van tweedimensionale materialen
Visualisatie van de ingebedde, gedraaide interfaces van tweedimensionale materialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

