
Wetenschap
Wetenschappers temmen chaotische eiwitten die 75% van de kankers voeden
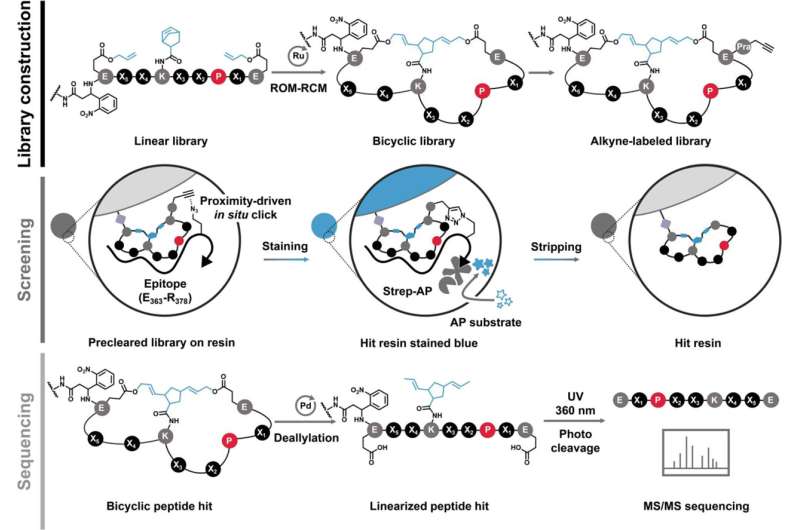
MYC is het vormeloze eiwit dat verantwoordelijk is voor het verergeren van de meerderheid van de gevallen van kanker bij de mens. Onderzoekers van UC Riverside hebben een manier gevonden om dit in toom te houden, wat hoop biedt voor een nieuw tijdperk van behandelingen.
In gezonde cellen helpt MYC het transcriptieproces te begeleiden, waarbij genetische informatie wordt omgezet van DNA in RNA en uiteindelijk in eiwitten. "Normaal gesproken wordt de activiteit van MYC strikt gecontroleerd. In kankercellen wordt het hyperactief en wordt het niet goed gereguleerd", zegt Min Xue, universitair hoofddocent scheikunde aan de UCR.
"MYC lijkt minder op voedsel voor kankercellen en meer op een steroïde die de snelle groei van kanker bevordert," zei Xue. "Dat is de reden waarom MYC een boosdoener is in 75% van alle gevallen van kanker bij de mens."
Aan het begin van dit project geloofde het UCR-onderzoeksteam dat als ze de hyperactiviteit van MYC konden temperen, ze een venster konden openen waarin de kanker onder controle kon worden gebracht.
Het vinden van een manier om MYC onder controle te houden was echter een uitdaging, omdat MYC, in tegenstelling tot de meeste andere eiwitten, geen structuur heeft. "Het is eigenlijk een klodder willekeur", zei Xue. "Conventionele pijplijnen voor het ontdekken van geneesmiddelen zijn afhankelijk van goed gedefinieerde structuren, en die bestaan niet voor MYC."
Een nieuw artikel in het Journal of the American Chemical Society , waarvan Xue de hoofdauteur is, beschrijft een peptideverbinding die zich aan MYC bindt en de activiteit ervan onderdrukt.
In 2018 merkten de onderzoekers dat het veranderen van de stijfheid en vorm van een peptide het vermogen ervan verbetert om te interageren met structuurloze eiwitdoelen zoals MYC.
"Peptiden kunnen verschillende vormen, vormen en posities aannemen," zei Xue. "Als je ze eenmaal hebt gebogen en verbonden om ringen te vormen, kunnen ze geen andere mogelijke vormen aannemen, waardoor ze een laag niveau van willekeur hebben. Dit helpt bij het binden."
In het artikel beschrijft het team een nieuw peptide dat zich rechtstreeks aan MYC bindt met zogenaamde sub-micro-molaire affiniteit, wat dichter bij de sterkte van een antilichaam komt. Met andere woorden, het is een zeer sterke en specifieke interactie.
"We hebben de bindingsprestaties van dit peptide vergeleken met eerdere versies met twee ordes van grootte verbeterd", aldus Xue. "Dit brengt het dichter bij onze doelstellingen voor de ontwikkeling van geneesmiddelen."
Momenteel gebruiken de onderzoekers lipide-nanodeeltjes om het peptide in cellen af te leveren. Dit zijn kleine bolletjes gemaakt van vetmoleculen en niet ideaal om als medicijn te gebruiken. In de toekomst ontwikkelen de onderzoekers chemie die het vermogen van het hoofdpeptide om in de cellen te komen verbetert.
Zodra het peptide zich in de cel bevindt, zal het binden aan MYC, waardoor de fysieke eigenschappen van MYC veranderen en voorkomen wordt dat het transcriptieactiviteiten uitvoert.
Xue's laboratorium aan UC Riverside ontwikkelt moleculaire hulpmiddelen om de biologie beter te begrijpen en gebruikt die kennis om geneesmiddelen te ontdekken. Hij is al lang geïnteresseerd in de chemie van chaotische processen, wat hem aantrok tot de uitdaging om MYC te temmen.
"MYC vertegenwoordigt in feite chaos, omdat het structuur mist. Dat, en de directe impact ervan op zoveel soorten kanker, maken het tot een van de heilige graals van de ontwikkeling van kankergeneesmiddelen," zei Xue. "We zijn erg blij dat het nu binnen ons bereik ligt."
Meer informatie: Zhonghan Li et al., MYC-gerichte remmers gegenereerd uit een stereodiversified bicyclic peptidebibliotheek, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c09615
Journaalinformatie: Journaal van de American Chemical Society
Aangeboden door Universiteit van Californië - Riverside
 De in de aarde overvloedige ijzerkatalyse maakt toegang tot waardevolle gedialkyleerde verbindingen mogelijk
De in de aarde overvloedige ijzerkatalyse maakt toegang tot waardevolle gedialkyleerde verbindingen mogelijk  Wetenschappers kijken naar vogelveren om kleuren af te drukken
Wetenschappers kijken naar vogelveren om kleuren af te drukken Boomringen gebruikt om smokkelaarsringen tegen te gaan
Boomringen gebruikt om smokkelaarsringen tegen te gaan Hoe het milieu te helpen:Zet bakolie om in hernieuwbare brandstoffen
Hoe het milieu te helpen:Zet bakolie om in hernieuwbare brandstoffen Ontdekking kan leiden tot krachtiger knoflook, het stimuleren van smaak en slechte adem
Ontdekking kan leiden tot krachtiger knoflook, het stimuleren van smaak en slechte adem
 De ervaring van Japan met aardbevingen kan ons helpen om te leren leven met overstromingen
De ervaring van Japan met aardbevingen kan ons helpen om te leren leven met overstromingen Demonstranten Hawaï beloven langdurige strijd tegen telescoop
Demonstranten Hawaï beloven langdurige strijd tegen telescoop Grote kijk op de impact van klimaatverandering op de Amerikaanse landbouw:het middenwesten loopt gevaar
Grote kijk op de impact van klimaatverandering op de Amerikaanse landbouw:het middenwesten loopt gevaar Chemici analyseren luchtvervuiling
Chemici analyseren luchtvervuiling De veerkracht van bossen neemt af door bosbranden, klimaatverandering
De veerkracht van bossen neemt af door bosbranden, klimaatverandering
Hoofdlijnen
- Wat is interfase, metafase en anafase?
- Nieuwe genetische variatie van oude en exotische variëteiten voor milieuvriendelijke tarweteelt
- Nieuwe ontdekking om de ontwikkeling van zouttolerante wijnstokken te versnellen
- In een gevecht tussen een wilde en een gedomesticeerde parkiet, wiens veren zouden vliegen?
- Hoe warm is te warm voor het menselijk lichaam?
- We volgen de voetstappen van het Noord-Chinese luipaard
- Overeenkomsten tussen verbranding en cellulaire ademhaling
- Soorten monomeren
- Verschillen tussen lichaamscellen en neuronen
- Structure-ID-techniek zou de chemie kunnen verschuiven naar warp-snelheid

- Een nieuwe klasse membranen belooft interessante toepassingen in materiaalscheiding

- Scheuren in 3D-geprinte metalen onderdelen elimineren

- Studie voorspelt reactie van hartcellen op afnemende zuurstof
- Zonnemateriaal kan onvolkomenheden zelf herstellen, nieuw onderzoek toont aan

 Onderzoekers creëerden een klein circuit door een enkel watermolecuul
Onderzoekers creëerden een klein circuit door een enkel watermolecuul NASA selecteert nieuwe technologieën voor vliegtesten voor toekomstige ruimteverkenning
NASA selecteert nieuwe technologieën voor vliegtesten voor toekomstige ruimteverkenning Tool meet dubieus nieuws op sociale media op tijd voor de verkiezingen van 2018
Tool meet dubieus nieuws op sociale media op tijd voor de verkiezingen van 2018 Welke carrières gebruiken lineaire vergelijkingen?
Welke carrières gebruiken lineaire vergelijkingen?  Negatieve effecten van Clear-Cutting
Negatieve effecten van Clear-Cutting  Irma:omgevallen bomen en gezonken boten, maar zuchten van verlichting in Miami
Irma:omgevallen bomen en gezonken boten, maar zuchten van verlichting in Miami Gletsjermuizen bewegen en dat heeft wetenschappers versteld doen staan
Gletsjermuizen bewegen en dat heeft wetenschappers versteld doen staan  Bimeronium:een nieuw lid van de familie van topologische spintexturen
Bimeronium:een nieuw lid van de familie van topologische spintexturen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

