
Wetenschap
Wat warmte ons kan vertellen over de chemie van batterijen:het Peltier-effect gebruiken om lithium-ioncellen te bestuderen
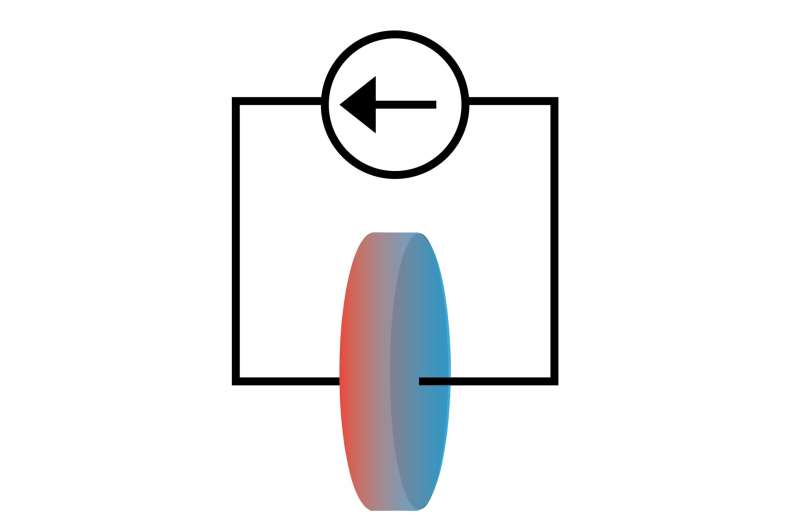
Batterijen worden meestal bestudeerd via elektrische eigenschappen zoals spanning en stroom, maar nieuw onderzoek suggereert dat het observeren van de manier waarop warmte stroomt in combinatie met elektriciteit belangrijke inzichten kan opleveren in de chemie van batterijen.
Een team van onderzoekers van de Universiteit van Illinois Urbana-Champaign heeft aangetoond hoe de chemische eigenschappen van lithium-ionbatterijcellen kunnen worden bestudeerd door gebruik te maken van het Peltier-effect, waarbij elektrische stroom ervoor zorgt dat een systeem warmte onttrekt. Gerapporteerd in het tijdschrift Physical Chemistry Chemical Physics Dankzij deze techniek konden ze experimenteel de entropie van de lithium-ion-elektrolyt meten, een thermodynamisch kenmerk dat rechtstreeks van invloed zou kunnen zijn op het ontwerp van lithium-ion-batterijen.
"Ons werk gaat over het begrijpen van de fundamentele thermodynamica van opgeloste lithiumionen, informatie waarvan we hopen dat deze de ontwikkeling van betere elektrolyten voor batterijen zal begeleiden", zegt David Cahill, hoogleraar materiaalkunde en techniek aan de Universiteit van I. en projectleider. "Door het gekoppelde transport van elektrische lading en warmte in het Peltier-effect te meten, kunnen we de entropie afleiden, een hoeveelheid die nauw verwant is aan de chemische structuur van de opgeloste ionen en hoe deze interageren met andere delen van de batterij."
Het Peltier-effect is goed bestudeerd in solid-state systemen waar het wordt gebruikt bij koeling en koeling. Het blijft echter grotendeels onontgonnen in ionische systemen zoals lithiumelektrolyt. De reden is dat de temperatuurverschillen die door Peltier-verwarming en -koeling ontstaan, klein zijn in vergelijking met andere effecten.
Om deze barrière te overwinnen, gebruikten de onderzoekers een meetsysteem dat een honderdduizendste graad Celsius kon meten. Hierdoor konden de onderzoekers de warmte tussen de twee uiteinden van de cel meten en deze gebruiken om de entropie van de lithium-ionelektrolyt in de cel te berekenen.
"We meten een macroscopische eigenschap, maar deze onthult nog steeds belangrijke informatie over het microscopische gedrag van de ionen", zegt Rosy Huang, een afgestudeerde student in de onderzoeksgroep van Cahill en co-hoofdauteur van de studie. "Metingen van het Peltier-effect en de entropie van de oplossing zijn nauw verbonden met de solvatatiestructuur. Voorheen vertrouwden batterijonderzoekers op energiemetingen, maar entropie zou een belangrijke aanvulling zijn op die informatie die een completer beeld van het systeem geeft." P>
De onderzoekers onderzochten hoe de Peltier-warmtestroom veranderde met de concentratie van lithiumionen, het type oplosmiddel, het elektrodemateriaal en de temperatuur. In alle gevallen constateerden ze dat de warmtestroom tegengesteld was aan de ionenstroom in de oplossing, wat impliceert dat de entropie van het oplossen van lithiumionen kleiner is dan de entropie van vast lithium.
Het vermogen om de entropie van lithium-ion-elektrolytoplossingen te meten kan belangrijke inzichten opleveren in de mobiliteit van de ionen, die de oplaadcyclus van de batterij bepalen en hoe de oplossing samenwerkt met de elektroden, een belangrijke factor in de levensduur van de batterij.
"Een ondergewaardeerd aspect van het batterijontwerp is dat de vloeibare elektrolyt niet chemisch stabiel is wanneer hij in contact komt met de elektroden", aldus Cahill. "Het ontleedt altijd en vormt iets dat een vaste-elektrolyt-interfase wordt genoemd. Om een batterij gedurende lange cycli stabiel te maken, moet je de thermodynamica van die interfase begrijpen, en dat is wat onze methode helpt."
Zhe Cheng is de tweede co-hoofdauteur van het onderzoek. Beniamin Zahiri, Patrick Kwon en Paul Braun, hoogleraar materiaalkunde en techniek van I., hebben ook bijgedragen aan dit werk.
Meer informatie: Zhe Cheng et al, Ionisch Peltier-effect in Li-ion-elektrolyten, Fysische chemie Chemische fysica (2024). DOI:10.1039/D3CP05998G
Journaalinformatie: Fysische chemie Chemische fysica
Aangeboden door Grainger College of Engineering van de Universiteit van Illinois
 Difference Between Strength & Concentration
Difference Between Strength & Concentration Regeling van bellenvorming op elektroden
Regeling van bellenvorming op elektroden Hydrogels zijn veelbelovend als een nieuwe manier om medicijnen efficiënter af te leveren
Hydrogels zijn veelbelovend als een nieuwe manier om medicijnen efficiënter af te leveren  Schimmelwegen op kaaskorst beïnvloeden voedselveiligheid, rijpheid
Schimmelwegen op kaaskorst beïnvloeden voedselveiligheid, rijpheid Hoe de aanwezigheid van insecticiden in groenten en fruit te detecteren
Hoe de aanwezigheid van insecticiden in groenten en fruit te detecteren
 Wat is een aardbeving in de aardbeving?
Wat is een aardbeving in de aardbeving?  Nieuwe online tool toont klimaatverandering in je achtertuin
Nieuwe online tool toont klimaatverandering in je achtertuin Onderzoeksteam brengt nieuw AI-model uit voor weer- en klimaattoepassingen
Onderzoeksteam brengt nieuw AI-model uit voor weer- en klimaattoepassingen  Colorado bergen stuiteren terug van zure regen inslagen
Colorado bergen stuiteren terug van zure regen inslagen Luchtvervuiling in wereldwijde megasteden gekoppeld aan cognitieve achteruitgang van kinderen, Alzheimer en de dood
Luchtvervuiling in wereldwijde megasteden gekoppeld aan cognitieve achteruitgang van kinderen, Alzheimer en de dood
Hoofdlijnen
- Hoe jaarrond gewassen de vervuiling van de boerderij in de Mississippi-rivier kunnen verminderen
- Er is een genetische reden waarom Labrador Retrievers geobsedeerd zijn door voedsel
- Een recordaantal van 1.101 zeekoeien uit Florida stierven in 2021. Wanneer stopt het?
- Celstructuurdefinities
- Hoe verouderende klokken tikken:nieuwe studie wijst op stochastische veranderingen in cellen
- Wetenschappers identificeren een gen dat kan leiden tot veerkrachtige elfenmaïs
- Radiologie werpt licht op oude vissoorten coelacanth
- 12-jarige studie van straatkatten onthult hoe populatieaantallen met succes onder controle kunnen worden
- Wat zijn 3 functies van de navelstreng?
- Nieuwe techniek om de ductiliteit van keramische materialen voor raketten te verbeteren, motoren

- Ontdekken hoe T-cellen het SARS-COV-2 virus spike-eiwit herkennen
- Team neemt het giswerk weg bij het ontdekken van nieuwe legeringen met hoge entropie

- Schuifkracht:hoe goede materialen beter worden gemaakt?

- Nauwkeurige analyse van de deeltjessamenstelling van smog

 Hoe microscopisch kleine zeealgen omgaan met veranderende oceaanomstandigheden
Hoe microscopisch kleine zeealgen omgaan met veranderende oceaanomstandigheden Ze hebben het bos voor altijd beheerd. Daarom zijn ze de sleutel tot de strijd tegen klimaatverandering
Ze hebben het bos voor altijd beheerd. Daarom zijn ze de sleutel tot de strijd tegen klimaatverandering Wanneer gebeurt er wanneer mitose verkeerd gaat en in welke fase zal het verkeerd gaan?
Wanneer gebeurt er wanneer mitose verkeerd gaat en in welke fase zal het verkeerd gaan?  Tweelingbranden in Californië zijn de op een na grootste in de geschiedenis van de staat
Tweelingbranden in Californië zijn de op een na grootste in de geschiedenis van de staat Goedkoop, energiezuinige en schone reactie om chemische grondstof te maken
Goedkoop, energiezuinige en schone reactie om chemische grondstof te maken Het monitoren van milieublootstelling bij honden kan een vroegtijdig waarschuwingssysteem zijn voor de menselijke gezondheid
Het monitoren van milieublootstelling bij honden kan een vroegtijdig waarschuwingssysteem zijn voor de menselijke gezondheid Een pandemie binnen een pandemie:COVID-19, protesten schijnen ongelijkheid in de schijnwerpers
Een pandemie binnen een pandemie:COVID-19, protesten schijnen ongelijkheid in de schijnwerpers Nieuw bewijs suggereert dat de Devoon Nekton-revolutie nooit heeft plaatsgevonden
Nieuw bewijs suggereert dat de Devoon Nekton-revolutie nooit heeft plaatsgevonden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

