Wetenschap
Het aantal atomen in een monster berekenen
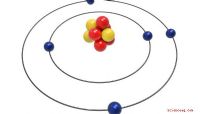
Een atoom is de kleinst mogelijke hoeveelheid van een chemisch element dat nog steeds alle eigenschappen van dat element heeft. Hoewel je ze kunt behandelen als afzonderlijke brokken materie, bestaan ze op hun beurt uit meer fundamentele deeltjes, het proton, neutron en elektron. Enig begrip van de structuur van het atoom is belangrijk omdat elektronen en protonen de elektrische ladingen vertonen die alles in de chemie aandrijven. Wanneer u met een monster van een element of verbinding werkt, gebruikt u het getal van Avogadro om het aantal atomen in het monster te berekenen.
TL; DR (te lang; niet gelezen)
Naar bereken het aantal atomen in een monster, vind de molaire massa van de stof, weeg het monster, deel het gemeten gewicht door de molaire massa, vermenigvuldig dan met het getal van Avogadro.
het getal van Avogadro en de mol
Het getal van Avogadro, ook bekend als de constante van Avogadro, kwantificeert het aantal koolstof-12-atomen in een monster van 12 gram van de stof. Omdat atomen erg klein zijn, is het aantal erg groot, 6.022 x 10 ^ 23. Chemici gebruiken een eenheid die mol wordt genoemd om een hoeveelheid deeltjes te meten die gelijk is aan het aantal van Avogadro in een monster; bijvoorbeeld, een mol koolstof-12 weegt 12 gram, dus de molaire massa koolstof-12 is 12 gram per mol. Merk op dat de molaire massa stikstofatomen 14,01 gram per mol is, maar omdat stikstofgas twee atomen per molecuul heeft, is de molaire massa van het molecuul 28,02 gram per mol.
Weeg het monster
Weeg de monster op een gram-schaal en noteer het gewicht. Of het gewicht is mogelijk al aan u verstrekt; zo ja, gebruik dat cijfer. Na het wegen weegt u bijvoorbeeld dat een aluminiummonster 6,00 gram weegt.
Periodiek systeem opzoeken
Zoek het element op het periodiek systeem en zoek naar de atoommassa, meestal het getal onder het chemische symbool . Voor monsters van zuivere elementen is atomaire massa de molaire massa, wat op zijn beurt het aantal gram per mol is. De molaire massa van aluminium is bijvoorbeeld 26.982 g /mol.
Deel gewicht door Molaire massa
Deel het gramgewicht van uw monster door de molaire massa van de stof. Het resultaat van deze berekening is het aantal mol stof. Om het voorbeeld voort te zetten, geeft 6,00 gemeten gram van het aluminiummonster gedeeld door 26,982 g /mol 0,222 mol.
Vermenigvuldig met Avogadro's getal
Vermenigvuldig het aantal mol in uw monster met de atomen per mol, Avogadro's nummer. Het resultaat is het uiteindelijke antwoord - het aantal atomen in uw monster. In het voorbeeld hebt u 0,222 mol berekend. Vermenigvuldig .222 mol met 6.022 x 10 ^ 23 atomen per mol om tot het antwoord te komen, 1,34 x 10 ^ 23 atomen.
Hoofdlijnen
- Wat is zelfrespect?
- Waarom wordt magnesiumchloride gebruikt in PCR?
- Welke landen hebben de kleinste persoonlijke ruimte?
- Moeders geven de voorkeur aan dochters,
- Geslachtschromosomen (Allosome): definitie, feiten en voorbeelden
- De rol van Taq Polymerase in PCR
- De structurele verschillen tussen zenuwen en bloedvaten
- Hoe water door planten beweegt
- Is het menselijk brein nog in ontwikkeling?
 Grafische rekenmachine: hoe maak je een gezicht
Grafische rekenmachine: hoe maak je een gezicht 10 manieren om een dodelijke asteroïde te stoppen
10 manieren om een dodelijke asteroïde te stoppen  10 verrassende feiten over astronautentraining
10 verrassende feiten over astronautentraining  De grondbeginselen van calculus
De grondbeginselen van calculus  Hoe een onbekende bacterie te identificeren in de microbiologie
Hoe een onbekende bacterie te identificeren in de microbiologie Prijs van gegalvaniseerd staal versus Roestvrij staal
Prijs van gegalvaniseerd staal versus Roestvrij staal Wat zijn Brisling Sardines?
Wat zijn Brisling Sardines?  Wild Hunts
Wild Hunts
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com