
Wetenschap
Nieuw onderzoek zet glucosetransporteiwitten om in wateroplosbare vorm
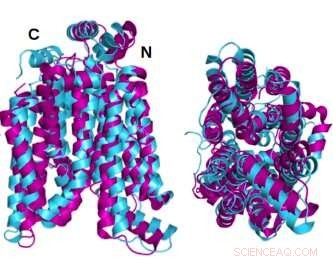
Twee hoeken van de kristallijne structuur GLUT1 (magenta) glucosetransporteiwit gesuperponeerd met de AlphaFold2 computer-voorspelde in water oplosbare variant van hetzelfde eiwit (cyaan) tonen aan dat het kristallijne eiwit en zijn in water oplosbare QTY-variant een opmerkelijke structurele overeenkomst delen. Krediet:Shuguang Zhang Laboratory, MIT
Alle celmembranen in het menselijk lichaam hebben ingebedde eiwitten die dienen als sensoren, boodschappers of als middel voor het transporteren en reguleren van stoffen die de cel in en uit gaan. Vooral transporteiwitten worden slecht begrepen vanwege hun structurele complexiteit en hun hydrofobe aard waardoor ze resistent zijn tegen onderzoek. Tegelijkertijd spelen deze transporteiwitten, vooral die welke glucose reguleren, een vitale rol bij de groei van kankertumoren.
In een nieuwe studie hebben wetenschappers onder leiding van Dr. Shuguang Zhang, Ph.D. van het MIT Media Lab, demonstreren een methode voor het snel voorspellen van het ontwerp van hydrofiele variantstructuren van de 14 glucosetransportmembraaneiwitten in cellen. Hierdoor kunnen onderzoekers de eiwitten in water gemakkelijker bestuderen. De wetenschappers bevestigen de nauwkeurigheid van de voorspelde structuren door ze te vergelijken met reeds bestaande kristallografische beelden van twee van de eiwitten.
Ze hopen dat een beter begrip van deze glucosetransporteiwitten de ontwikkeling van therapeutische monoklonale antilichamen voor de behandeling van kankermetastasen zal versnellen. Dit zou in wezen kankercellen uithongeren door glucosetransporters te blokkeren.
"De meeste kankercellen verhogen hun expressie en productie van glucosetransporters, GLUT's genaamd, aanzienlijk vanwege hun onverzadigbare energiebehoefte", zegt Eva Smorodina, een niet-gegradueerde stagiaire in structurele biologie aan het Greiff Lab, Universiteit van Oslo, die eerste auteur is van een paper over de studie gepubliceerd op 27 juni in QRB Discovery . "Momenteel zijn er bijna geen effectieve medicijnen om GLUT's te blokkeren, omdat ze een uitdagende structuur hebben."
De complexe structuren van de GLUT's omvatten 12 transmembraan hydrofobe helices ingebed in het membraan. In hun natuurlijke of kristallijne toestand moeten de hydrofobe structuren in een speciaal detergens of reagens worden geplaatst voor laboratoriumonderzoek, anders verliezen ze hun structuur. En met eiwitten zijn structuur en functie onuitwisbaar met elkaar verbonden.
"Het bestuderen van deze eiwitten in wasmiddel is als het dragen van zware handschoenen om een duur horloge in elkaar te zetten of om een viool te spelen", zegt Dr. Zhang, een van de weinige biomedische wetenschappers voor wie de studie van membraaneiwitten even dwingend als essentieel is voor ons begrip. van kankercellen. Begin jaren 2000 begon hij te werken aan membraaneiwitten. "Weinig mensen bestudeerden deze membraaneiwitten", zegt Dr. Zhang. "Ze zijn als een hete aardappel", zegt hij, vanwege hun inherente weerstand tegen studie.
Het nieuwe werk is gebaseerd op het succes van Dr. Zhang vier jaar geleden, toen hij en een team bereikten waar Dr. Zhang bijna tien jaar aan had gewerkt:ze ontwierpen een prachtig eenvoudige methode genaamd de QTY-code voor het transformeren van een hydrofoob celmembraaneiwit in een hydrofiel eiwit door veel hydrofobe aminozuren te vervangen.
De QTY-code is genoemd naar de symbolen van de drie aminozuren - glutamine (Q), threonine (T) en tyrosine (Y) - die worden vervangen door vier hydrofobe aminozuren:leucine (L), isoleucine (I), valine ( V) en fenylalanine (F). Geen van deze aminozuren draagt een lading, wat de substitutie goedaardig maakt. Structuur is essentieel voor het functioneren van de eiwitten, en de substitutie verandert niets aan de structuur.
In de laatste studie passen Dr. Zhang en team de QTY-code toe op de 14 glucosetransportmembraaneiwitten die suiker naar cellen transporteren. Ze gebruikten het nieuwe AlphaFold2-programma, een op kunstmatige intelligentie gebaseerd computerprogramma ontwikkeld door het bedrijf DeepMind, dat nauwkeurig en snel kan voorspellen hoe eiwitten zich vouwen. Dr. Zhang en team gebruikten de QTY-code met de open-source AlphaFold2 om de alfa-spiraalvormige vormen van de 14 GLUT-eiwitten te voorspellen in zowel hun natuurlijke hydrofobe vormen als hun door QTY-code gewijzigde in water oplosbare vormen.
De kristallijne of natieve toestandsstructuren van twee van de GLUT's - 1 en 3 - waren eerder onthuld door andere onderzoekers met behulp van röntgenkristallografie. Om hun eigen methodologie te onderbouwen, voorspelde het team van Dr. Zhang eerst de hydrofiele structuur van die twee GLUT's door de aminozuurvervangingen van de QTY-code toe te passen en AlphaFold2 de vormen van de eiwitten te laten voorspellen. Het deed dat met grote nauwkeurigheid. De boven elkaar geplaatste hydrofobe en hydrofiele beelden zijn bijna identiek.
Het team volgde deze bevestiging op door QTY-code en AlphaFold2 te combineren om de hydrofiele structuren van de 12 andere GLUT's in recordtijd te voorspellen. "In 2018 duurde het vier tot vijf weken met behulp van een supersnel computercluster om elke eiwitstructuur te simuleren", zegt Dr. Zhang. "Met AlphaFold2 kunnen we gratis een Google-computer gebruiken en simuleert het de transmembraaneiwitten in uren. Sommige kleine eiwitten duurden minder dan een uur."
"Dit onderzoek naar menselijke membraanglucosetransporters en hun in water oplosbare QTY-varianten van het Zhang-laboratorium aan het MIT is fascinerend", zegt professor Joel Sussman van het Weizmann Institute of Science in Rehovot, Israël, die niet bij het werk betrokken was. "Het biedt experimentele visualisatie via röntgenkristallografie en AI-voorspelling met behulp van AlphaFold2 om, voor het eerst, met atomaire resolutie, de verschillen te zien tussen hydrofobe 'waterhatende' helices en hydrofiele 'waterminnende' helices. Het is een kritische step in using the QTY code method to study multispan transmembrane proteins and other aggregated proteins through their water-soluble variants, and is likely to have an enormous impact in the field of biotechnology."
MIT Professor Robert Langer, whose work in biomedical engineering is highly celebrated, says, "The [QRB Discovery ] paper is excellent, and I believe has the potential to help a lot of cancer patients." Professor Langer was not involved in the research.
Authors of the QRB Discovery paper are Dr. Zhang and Smorodina; Fei Tao and Rui Qing of Shanghai Jiaotong University (Dr. Qing was previously a postdoctoral researcher in the MIT Media Lab and later a research scientist at the Koch Institute for Integrative Cancer Research at MIT); Dr. Steve Yang an MIT alumnus now at PT Metiska Farma in Indonesia; and Dr. David Jin, M.D., Ph.D. of Avalon GloboCare Corp., who stimulated Dr. Zhang to apply the QTY code to the study of cancer cells. Avalon GloboCare also funded the research.
Dr. Jin says he hopes—but this is not part of the current study—that future research will be able to genetically alter the glucose passage membranes to develop novel therapeutic targets.
"Now our only choices for cancer treatment are surgery, chemo or small-molecule therapy," says Dr. Jin. "In future, it may be possible to take a patient's T-cell, a component of the immune system, and genetically modify it in the lab so that it can work almost like a cancer-searching GPS system with a tumor-attacking capability." + Verder verkennen
Scientists alter membrane proteins to make them easier to study
 Katalysatorstudie bevordert de conversie van kooldioxide naar ethanol
Katalysatorstudie bevordert de conversie van kooldioxide naar ethanol Een nieuw materiaal dat in staat is tot de adsorptie van organische verontreinigende stoffen in water
Een nieuw materiaal dat in staat is tot de adsorptie van organische verontreinigende stoffen in water Onderzoekers ontwikkelen geminiaturiseerde nucleaire magnetische resonantie voor olie- en gasexploratie
Onderzoekers ontwikkelen geminiaturiseerde nucleaire magnetische resonantie voor olie- en gasexploratie Beschrijf de vorming van zowel positieve als negatieve ionen
Beschrijf de vorming van zowel positieve als negatieve ionen Systematische studie lost discussie over katalysatorontwerp voor uitlaatgassen van auto's op
Systematische studie lost discussie over katalysatorontwerp voor uitlaatgassen van auto's op
 Wetenschappers testen een microalgentechnologie voor afvalwaterzuivering
Wetenschappers testen een microalgentechnologie voor afvalwaterzuivering Koraaltransplantatie verhoogt de hoop op overleving van het Barrièrerif
Koraaltransplantatie verhoogt de hoop op overleving van het Barrièrerif Wetenschappers bereiden zich voor op expeditie van een jaar naar Arctisch centrum
Wetenschappers bereiden zich voor op expeditie van een jaar naar Arctisch centrum Opinie:de toekomst van de uitstoot van broeikasgassen voorspellen
Opinie:de toekomst van de uitstoot van broeikasgassen voorspellen drones, supercomputers en sonar ingezet tegen overstromingen
drones, supercomputers en sonar ingezet tegen overstromingen
Hoofdlijnen
- Waarom zout zouthoudend water ontmoedigen?
- Hoeveel tijd kost het om een DNA-molecuul te repliceren?
- Vroege detectiesysteem voor hinderlijke algenplagende Papahānaumokuākea-riffen
- Eenvoudig diermodel laat zien hoe omgeving en toestand zijn geïntegreerd om gedrag te beheersen
- Producten geproduceerd door Anaerobe ademhaling
- De Saguaro Cactus is een iconisch symbool van het Amerikaanse zuidwesten
- Convergente evolutie van mimetische vlinders verwart classificatie
- Waarom we trekdieren niet te snel de schuld moeten geven van wereldwijde ziekten
- Beschrijving van de basisfuncties van enzymen in cellen
- Biotech-doorbraak verandert afvalbiomassa in hoogwaardige chemicaliën

- Beeldvorming van structurele veranderingen in katalysatoren tijdens reactieomstandigheden

- Beeldvorming met superresolutie onthult het mechanisme van GLUT1-clustering
- Video:Kan Google u helpen de vlekken te verwijderen?

- Heeft komeetinslagen het leven op aarde een boost gegeven?

 Planten die snel groeien voor wetenschapsprojecten
Planten die snel groeien voor wetenschapsprojecten Koolstof- en stikstofcycli interageren met vegetatieverschuivingen
Koolstof- en stikstofcycli interageren met vegetatieverschuivingen Ultrasnel en gekoppeld:atoomtrillingen in het kwantummateriaal boornitride
Ultrasnel en gekoppeld:atoomtrillingen in het kwantummateriaal boornitride Soorten schimmels in de toendra
Soorten schimmels in de toendra  Hoe verhoudingen verdelen
Hoe verhoudingen verdelen  Ruimtevaartorganisatie:menselijke urine kan helpen bij het maken van beton op de maan
Ruimtevaartorganisatie:menselijke urine kan helpen bij het maken van beton op de maan Stijgende religieuze geen-tarieven gekoppeld aan conservatieve christelijke politiek
Stijgende religieuze geen-tarieven gekoppeld aan conservatieve christelijke politiek In Ivoorkust, wereldwijde rubberovervloed vernietigt winst
In Ivoorkust, wereldwijde rubberovervloed vernietigt winst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

