Wetenschap
Beeldvorming met superresolutie onthult het mechanisme van GLUT1-clustering
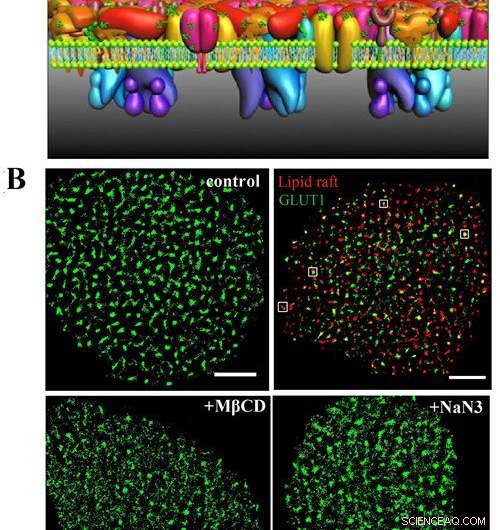
A) Dit is het PLLPI-model van het celmembraan. B) dSTORM-beelden van GLUT1 op het celmembraan; GLUT1 en lipide vlotten; en GLUT1-verdeling na behandeling met MβCD en NaN3. Schaalbalken, 5 m. Krediet:GAO Jing
Glucose is de primaire energiebron en substraat voor cellen, en de opname ervan door het celplasmamembraan is grotendeels afhankelijk van de glucosetransportfamilie (GLUT). GLUT1, een van de GLUT-familieleden, is een alom tot expressie gebracht membraaneiwit. Het is verantwoordelijk voor de constante opname van glucose in veel weefsels.
Yan et al. rapporteerde in 2014 de kristalstructuur van menselijk GLUT1 met een resolutie van 3,2 angstrom. de gedetailleerde verdeling van GLUT1 op natieve celmembranen was niet duidelijk, en hoe eiwitorganisaties zich verbinden met hun fysiologische functies bleef onbekend. Met de wijziging en actualisering van de celmembraanstructuur, veel studies hebben de heterogene en clustering distributie van membraaneiwitten gevonden.
Een recent eiwitlaag-lipide-eiwit-eiland (PLLPI) membraanmodel benadrukte dat een dichte eiwitlaag gevormd aan de ectoplasmatische kant van het membraan en gedispergeerde eiwitmicrodomeinen gevormd aan de cytoplasmatische kant. Om de distributiekenmerken en de onderliggende organisatiemechanismen van GLUT1 aan te pakken, superresolutie fluorescentiemicroscopie heeft een bijzonder geschikt hulpmiddel opgeleverd. Het doorbreekt de diffractiebarrière en bereikt een laterale resolutie in de tientallen nanometers. Het is zeer geschikt om de grootte en stabiliteit van eiwitaggregaties direct te monitoren.
Prof. WANG Hongda van het Changchun Instituut voor Toegepaste Chemie, Chinese Academie van Wetenschappen en Prof. XIONG Wenyong van het Kunming Institute of Botany, samen met hun teamleden, onderzocht eerst de distributie en assemblage van GLUT1 bij een resolutie van nanometer door directe stochastische optische reconstructiemicroscopie (dSTORM).
Ze ontdekten dat de transporter clusters vormde met een gemiddelde diameter van ~ 250 nm op HeLa-celmembranen. Er was een precieze ruimtelijke associatie tussen GLUT1 en lipid rafts, die het debat rond de lokalisatie van de transporter in membraandomeinen oploste.
Wat betreft het organisatiemechanisme van GLUT1-clusters, ze onthulden dat niet alleen de omgeving van de lipid rafts hun bestaan kan stabiliseren, maar het actine-cytoskelet en N-glycosylering spelen ook een belangrijke rol bij de vorming van de clusters.
Bovendien, ze ontdekten dat de activering van GLUT1 door natriumazide of MβCD de membraanexpressie ervan niet verhoogde, maar de afname van de grote clusters induceerde.
De resultaten suggereerden een mogelijk verband tussen distributie en activering. Het werk van hun teams kan een stap voorwaarts zijn in ons begrip van het moleculaire mechanisme van GLUT-clustering en glucoseopname.
 Evolutionaire koppelingsanalyse identificeert de impact van ziektegerelateerde varianten
Evolutionaire koppelingsanalyse identificeert de impact van ziektegerelateerde varianten De zwavelshuttle stoppen voor betere batterijen
De zwavelshuttle stoppen voor betere batterijen Slimme oplossing om bederf van zeevruchten op te sporen
Slimme oplossing om bederf van zeevruchten op te sporen Uitdaging voorspelt hoe metalen met complexe vormen en fabricage zullen breken
Uitdaging voorspelt hoe metalen met complexe vormen en fabricage zullen breken Nieuwe aanpak maakt spectroscopie op individuele moleculen mogelijk
Nieuwe aanpak maakt spectroscopie op individuele moleculen mogelijk
 NASA kijkt naar tropische cyclonen Irwin en Hilary regenval en Fujiwara-effect
NASA kijkt naar tropische cyclonen Irwin en Hilary regenval en Fujiwara-effect Mongoolse mijnbouwexplosie bedreigt traditionele hoeden
Mongoolse mijnbouwexplosie bedreigt traditionele hoeden Tegendraads klimaat onthult wetenschappelijke fout, zet grote oceaanopwarmingsstudie op zijn kop
Tegendraads klimaat onthult wetenschappelijke fout, zet grote oceaanopwarmingsstudie op zijn kop Veranderingen in de oceaantransportband voorspelden abrupte klimaatveranderingen met vier eeuwen
Veranderingen in de oceaantransportband voorspelden abrupte klimaatveranderingen met vier eeuwen Hoe spinnen te identificeren in South Carolina
Hoe spinnen te identificeren in South Carolina
Hoofdlijnen
- Hormonen die calcium en fosfaat reguleren Homeostase
- Onderzoek onthult hoe verontreinigende stoffen de vroege embryonale ontwikkeling beïnvloeden
- Techniek op de plaats delict die wordt gebruikt om schildpadden te volgen
- Wat veroorzaakt het uitsterven van planten en dieren?
- Wetenschappers onthullen eiwitstructuur die cruciaal is voor genexpressie
- Denk aan je eerste herinnering - waarom kun je het je niet eerder herinneren?
- Het veredelen van zeer productieve maïs heeft zijn aanpassingsvermogen verminderd
- Wetenschappers maken apparaat voor ultranauwkeurige genoomsequencing van afzonderlijke menselijke cellen
- Zelfs als je nog niet weet dat je ziek bent, je gezicht zal je verraden
 Nanoantenne-arrays voeden een nieuwe generatie op fluorescentie gebaseerde sensoren
Nanoantenne-arrays voeden een nieuwe generatie op fluorescentie gebaseerde sensoren Schatkamer met aanwijzingen voor aardbevingen kan worden opgegraven door nieuwe golvende techniek
Schatkamer met aanwijzingen voor aardbevingen kan worden opgegraven door nieuwe golvende techniek Metaal te gomachtig om te snijden? Teken erop met een Sharpie of lijmstift, wetenschap zegt
Metaal te gomachtig om te snijden? Teken erop met een Sharpie of lijmstift, wetenschap zegt Verdachte Ierse zijderoute uitgeleverd aan VS:aanklagers
Verdachte Ierse zijderoute uitgeleverd aan VS:aanklagers Econoom voorspelt banenverlies voor machines, maar ziet hoop op lange termijn
Econoom voorspelt banenverlies voor machines, maar ziet hoop op lange termijn Op weg naar het beheersen van terahertz-golven?
Op weg naar het beheersen van terahertz-golven? Het verschil tussen Pluto & Gas Giants
Het verschil tussen Pluto & Gas Giants Neurale netwerken hebben geleerd soortgelijke objecten op video's te herkennen zonder verslechtering van de nauwkeurigheid
Neurale netwerken hebben geleerd soortgelijke objecten op video's te herkennen zonder verslechtering van de nauwkeurigheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com