
Wetenschap
Onderzoek onthult nieuw mechanisme achter epilepsie en medicijnmodulatie
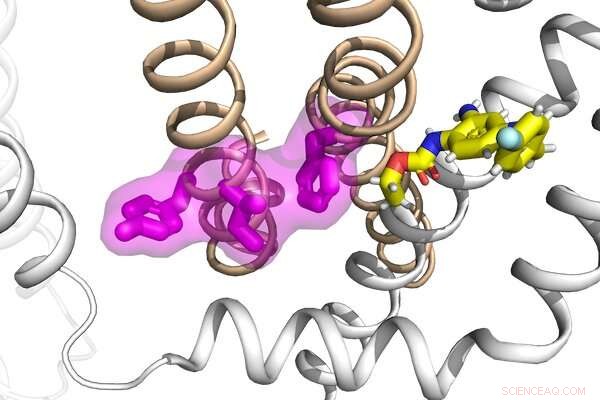
Onderzoekers in het laboratorium van Jianmin Cui hebben gekeken naar de mechanismen achter de functie en disfunctie van een groep eiwitten, evenals hun interacties met een anti-epilepticum, om een mogelijke nieuwe strategie te ontwikkelen om epilepsie te behandelen. Krediet:Cui-lab
Epilepsie is een neurologische aandoening die ontstaat door abnormale elektrische activiteit in de hersenen die leidt tot epileptische aanvallen. Deze aanvallen kunnen verschillende oorzaken hebben, waaronder genetische varianten in een familie van eiwitten die kaliumionen in de hersenen reguleren. Onderzoekers van de Washington University in St. Louis hebben een internationaal team geleid om de mechanismen achter de functie en disfunctie van deze eiwitten, evenals hun interacties met een anti-epilepticum, onder de loep te nemen om een mogelijke nieuwe strategie voor de behandeling van epilepsie te ontwikkelen.
Jianmin Cui, hoogleraar biomedische technologie aan de McKelvey School of Engineering, en Nien-Du Yang, een doctoraalstudent biomedische technologie die onderzoek doet in het laboratorium van Cui, werkten samen met Harley Kurata, universitair hoofddocent farmacologie aan de Universiteit van Alberta, en onderzocht het werkingsmechanisme van twee kaliumionkanalen, KCNQ2 en KCNQ3. Hun bevindingen onthullen een geconserveerd mechanisme voor KCNQ-kanaalactivering dat een doelwit is van zowel aan epilepsie gerelateerde mutaties als een verbinding met een klein molecuul.
Het werk werd op 20 juli gepubliceerd in Science Advances .
De KCNQ-kaliumkanaalfamilie heeft meerdere functies, van het reguleren van de hartslag (door KCNQ1) tot het regelen van de prikkelbaarheid van neuronen (door KCNQ2-5). Deze kanalen worden door spanning geactiveerd, zodat ze spanningsveranderingen over het celmembraan waarnemen en als reactie daarop openen en sluiten. De communicatie tussen spanningsdetectie en kanaalporie-opening staat bekend als elektromechanische koppeling, een proces waarbij conformationele veranderingen van het eiwit betrokken zijn tijdens spanningsafhankelijke activering.
Cui's team heeft eerder aangetoond dat KCNQ1, de cardiale KCNQ-isovorm, een tweetraps proces in elektromechanische koppeling heeft dat leidt tot twee verschillende open kanalen, de tussenliggende open en geactiveerde open. Regulering van de twee open toestanden ligt ten grondslag aan de weefselspecifieke modulaties, ziektepathogenese en farmacologie van KCNQ1. KCNQ2 en KCNQ3 komen sterk tot expressie in het centrale zenuwstelsel en leveren de belangrijkste bijdrage aan de M-stroom, een kritische kaliumstroom die de neuronale prikkelbaarheid moduleert. Daarom wordt een verminderde M-stroomfunctie door congenitale mutaties in KCNQ2 en KCNQ3 vaak geassocieerd met vroeg optredende epilepsie en pediatrische epilepsie.
"Hoewel KCNQ-kanalen zeer vergelijkbaar zijn in hun sequenties en structuren, is het onduidelijk of de neuronale KCNQ-isovormen ook hetzelfde elektromechanische koppelingsmechanisme of twee open toestanden delen", zegt Yang, de eerste auteur van het artikel. "Dit werk onthult belangrijke overeenkomsten en verschillen tussen deze kanalen die belangrijke implicaties kunnen hebben voor hun functie in cardiomyocyten of neuronen."
Het team gebruikte verschillende methoden om het elektromechanische koppelingsmechanisme in deze kaliumkanalen te bestuderen, waaronder het creëren van specifieke genetische mutaties in de kanalen, elektrofysiologie en optische fluorescentiemetingen.
"Het ophelderen van het moleculaire mechanisme voor elektromechanische koppeling is een belangrijke stap in de richting van het begrijpen van de spanningsafhankelijke poorten van kaliumkanalen," zei Cui. "We hebben functioneel bewijs geleverd dat de neuronale KCNQ2- en KCNQ3-kanalen verschillen van KCNQ1 waarin ze een enkele geactiveerde open toestand hebben, maar met een geconserveerd elektromechanisch koppelingsmechanisme dat specifiek is voor de geactiveerde open toestand."
Deze kanalen zijn belangrijke doelen voor behandelingen voor epilepsie, vonden de onderzoekers. Het team identificeerde ook een reeks mutaties in KCNQ2 en KCNQ3 die verband houden met vroege infantiele epileptische encefalopathie, een ernstige vorm van epilepsie bij kinderen, die specifiek de elektromechanische koppeling van de kanalen verstoort. De onderzoekers maakten gebruik van een anti-epileptisch prototype geneesmiddel retigabine gezien het werkingsmechanisme op neuronale KCNQ-kanalen en toonden aan dat de elektromechanische koppeling direct kan worden verbeterd om de functie van deze zieke mutanten te redden. Hun studies suggereren dat het elektromechanische koppelingsmechanisme in KCNQ-kanalen een effectief doelwit kan zijn, wat een nieuwe farmacologische strategie presenteert voor het ontwikkelen van effectievere therapieën voor de behandeling van epilepsie. + Verder verkennen
Kaliumkanaaldisfunctie bij genetische epilepsie
 Ontwikkeling van een nieuwe eindfunctionalisatietechniek in polymeersynthese
Ontwikkeling van een nieuwe eindfunctionalisatietechniek in polymeersynthese Nieuw polymeermengsel creëert ultragevoelige warmtesensor
Nieuw polymeermengsel creëert ultragevoelige warmtesensor Zelfherstellende folie op gelatinebasis kan een slimme zet zijn voor elektronica
Zelfherstellende folie op gelatinebasis kan een slimme zet zijn voor elektronica Chemicus stelt nieuwe methode voor voor groene synthese van xantheenderivaten
Chemicus stelt nieuwe methode voor voor groene synthese van xantheenderivaten Wat is pepperspray?
Wat is pepperspray?
 De wereld wordt natter, toch kan er minder water beschikbaar komen voor Noord-Amerika en Eurazië
De wereld wordt natter, toch kan er minder water beschikbaar komen voor Noord-Amerika en Eurazië Hoe een ijstijdparadox de voorspellingen van de zeespiegelstijging zou kunnen informeren
Hoe een ijstijdparadox de voorspellingen van de zeespiegelstijging zou kunnen informeren Feiten over de Pitcher Plant
Feiten over de Pitcher Plant Droogte verhoogt CO2-concentratie in de lucht
Droogte verhoogt CO2-concentratie in de lucht Hoe kan het gebruik van meststoffen resulteren in verminderde O2-concentraties in de waterwegen?
Hoe kan het gebruik van meststoffen resulteren in verminderde O2-concentraties in de waterwegen?
Hoofdlijnen
- Uit onderzoek blijkt dat door klimaatverandering hommels eerder uit de winterslaap komen, waardoor de soort gevaar loopt
- Het doel van elektroforese
- Difference Between Triglycerides & Phospholipids
- Wat is het diploïde nummer?
- Beschermde wateren bevorderen de heropleving van de westkust-zeebaars
- Hagedis, schildpad tussen meer dan 100 nieuwe soorten gevonden in Mekong-regio
- Wetenschappers ontdekken een genetisch mechanisme dat het opbrengstpotentieel van graangewassen zou kunnen verbeteren
- Plant- en diercelactiviteiten voor vierde graad
- Wilde zwijnengif veldtesten in Texas, Alabama in 2018
- Onderzoekers ontwikkelen nieuwe moleculaire ferro-elektrische metamaterialen

- Wetenschappers creëren op een eenvoudige manier onmogelijke materialen
- Nieuwe productiemethode voor fullereenkristal 50 keer sneller dan zijn voorganger

- Kleine aminozuurverschillen kunnen leiden tot dramatisch verschillende enzymen
- Zo mooi als een pauw:de edelsteen voor de volgende generatie slimme sensoren

 AI-graanbeoordeling zaait zaden voor een beter rendement
AI-graanbeoordeling zaait zaden voor een beter rendement Onderzoekers publiceren nieuwe studie over dankbaarheid in online communities
Onderzoekers publiceren nieuwe studie over dankbaarheid in online communities Efficiënt drugs de cellen in smokkelen
Efficiënt drugs de cellen in smokkelen April Fools hoax-verhalen kunnen aanwijzingen bieden om nepnieuws te identificeren
April Fools hoax-verhalen kunnen aanwijzingen bieden om nepnieuws te identificeren Buitengewone voorzitter, gewoon voorzitterschap
Buitengewone voorzitter, gewoon voorzitterschap Decibelstijging converteren naar procent
Decibelstijging converteren naar procent Wat is de formule voor zwavelzuur?
Wat is de formule voor zwavelzuur?  Manipuleren van oppervlaktespanning in vloeistoffen om aan verschillende industriële behoeften te voldoen
Manipuleren van oppervlaktespanning in vloeistoffen om aan verschillende industriële behoeften te voldoen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

