
Wetenschap
Dicht en permeabel:moleculaire organisatie van nauwe kruispunten gedecodeerd
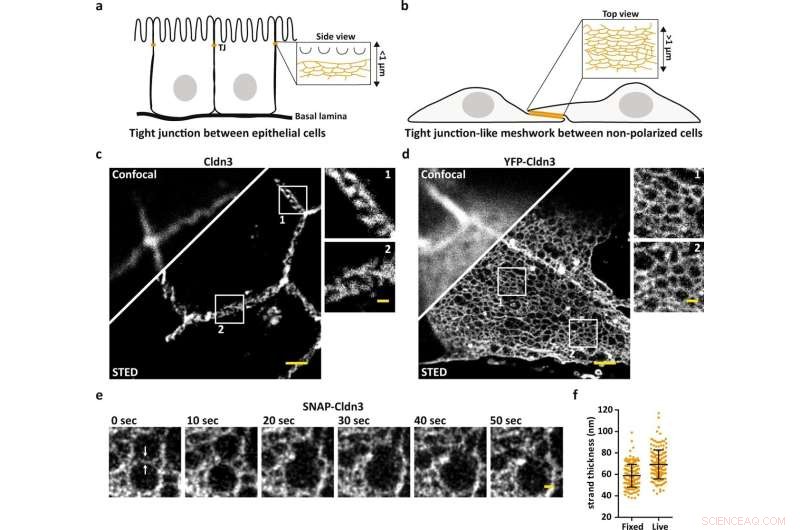
STED-microscopie onthult de organisatie op nanoschaal van TJ-netwerken. een schema dat de endogene TJ illustreert bij het meest apicale cel-tot-cel contact in epitheelcellen. b Schema dat TJ-achtig netwerk illustreert dat is gevormd in vlakke overlappende gebieden van met claudine getransfecteerde niet-gepolariseerde cellen. c, d Representatief confocaal en STED-beeld van een endogeen gevormd TJ gelabeld voor Cldn3 (2nd-Atto647N) tussen epitheelcellen van weefsel van de twaalfvingerige darm van de muis (c) en TJ-achtig netwerk gevormd door tot overexpressie gebracht YFP-Cldn3 (α-GFP-NB- Atto647N) tussen twee COS-7-cellen (d). e Representatieve eenkleurige STED-tijdreeks (1 frame/10 s) van een TJ-achtig netwerk in een overlappend gebied van levende COS-7-cellen die SNAP-Cldn3 (BG-JF646) tot expressie brengen. Witte pijlen geven de eerste strengbreuk aan, gevolgd door de fusie van twee kleinere mazen tot een grotere maas. Een Gaussiaanse vervaging met een sigma van 20 nm werd toegepast. f Full-wide-half-maximum (FWHM) meting van TJ-strengen van SNAP-Cldn3 (BG-JF646) in vaste en levende COS-7-cellen. Gegevens vertegenwoordigen het gemiddelde ± SD. Elk datapunt vertegenwoordigt één lijnprofiel van in totaal 160 lijnprofielen van 8 onafhankelijke TJ-achtige netwerken (n = 160). De totale FWHM resulteerde in 59 ± 11 nm voor vaste en in 69 ± 14 nm voor levende monsters. Alle representatieve afbeeldingen zijn afkomstig van 3 onafhankelijke experimenten. Schaalbalken, 1 m (c, d) en 200 nm (vergrotingen in c, d en e). Krediet:Natuurcommunicatie (2022). DOI:10.1038/s41467-022-32533-4
Ze sluiten epitheelcellen af en laten onder bepaalde omstandigheden de doorgang van ionen en water toe:nauwe verbindingen vormen een paracellulaire barrière in weefsels en hun disfunctie wordt geassocieerd met ziekten. Hoewel hun moleculaire componenten al sinds de jaren negentig bekend zijn, is het niet duidelijk hoe de 26 eiwitten die claudines worden genoemd, zijn georganiseerd.
Wetenschappers van het Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) hebben nu diep inzicht gekregen in de structuur van tight junctions, met behulp van superresolutie gestimuleerde emissiedepletie (STED) microscopie. Het is de eerste keer dat het basismechanisme dat ten grondslag ligt aan alle epitheliale barrière-eigenschappen is beschreven.
Tight junctions (TJ) zijn normaal gesproken uitstekend in het mogelijk maken van de doorgang van noodzakelijke ionen of moleculen, terwijl ze een dichte barrière vormen om te voorkomen dat ongewenste bacteriën en hun toxines het lichaam binnendringen. Deze paracellulaire barrières, die tegelijkertijd selectieve ion- en waterkanalen kunnen zijn, worden overal gevonden waar epitheelcellen of endotheelcellen elkaar ontmoeten, d.w.z. waar verschillende weefsels met elkaar zijn verbonden of wanneer het lumen van een orgaan moet worden afgesloten van de bloedstroom.
Het bestaan van tight junctions werd zo'n 60 jaar geleden ontdekt en hun belangrijkste moleculaire componenten zijn al 30 jaar bekend:26 membraaneiwitten die claudins worden genoemd. Afhankelijk van de cel zijn claudins georganiseerd in verschillende constellaties om semi-permeabele mazen te vormen tot enkele honderden nanometers breed. Meestal komen meerdere claudines samen, maar sommige barrières bestaan uit slechts een of twee structurele eiwitten.
Maar de vraag is, hoe zijn claudins georganiseerd om verschillende barrière-eigenschappen te creëren, afhankelijk van de cel of het weefsel in kwestie? En in hoeverre zijn claudins daarbij van elkaar afhankelijk? Tot nu toe zijn deze vragen onbeantwoord gebleven omdat het onmogelijk was om door de structuur van strengen te kijken, die slechts ongeveer tien nanometer dik zijn. Nu zijn wetenschappers van de FMP erin geslaagd om dat te doen met behulp van STED-microscopie.
"Dit type superresolutiemicroscopie en een uitstekend team van celbiologen, computerwetenschappers en fysiologen hebben ons geholpen om licht te werpen op de moleculaire architectuur van tight junctions", zegt Dr. Martin Lehmann, hoofd van de Cellular Imaging Group laatste auteur van de studie. "We zijn nu voor het eerst in staat om het mechanisme te beschrijven dat ten grondslag ligt aan de belangrijkste epitheliale barrière-eigenschappen."
STED gebruiken om enkelvoudige meshworks op te lossen
Normaal gesproken is de resolutie van fluorescentiemicroscopen beperkt tot ongeveer 250 nanometer. Met STED-microscopie is 50 nanometer of minder mogelijk. Dit gaf de onderzoekers letterlijk meer inzicht.
"Met standaard fluorescentiemicroscopie zouden we nooit de dichte organisatie van de tight junction zijn binnengedrongen, maar STED heeft ons in staat gesteld om de individuele mazen van het netwerk op te lossen. Als resultaat zijn we nu in staat om de exacte positie van eiwitten te bepalen, zoals en om te zien of claudins zich vermengen of scheiden, en hoe ze segregeren", zegt Hannes Gonschior, de eerste auteur van de studie, die zijn Ph.D. scriptie over het onderwerp op de FMP. "Deze organisatie op nanoschaal was voorheen onbekend."
Eerst werden de onderzoeken uitgevoerd op cellulair niveau en vervolgens in darm- en nierweefsel van muizen. Opvallende afbeeldingen reproduceerden de fluorescerend gelabelde eiwitten in verschillende kleuren, en lieten zien waar welke eiwitten zich bevinden en hoe ze aan elkaar vasthaken om een kleurrijke rits te vormen.
Drie bevindingen uit het onderzoek, nu gepubliceerd in Nature Communications , zijn van bijzonder belang:
- Ten eerste:Claudins sluiten intercellulaire ruimten af voor ionen en kleine moleculen, net als een rits. Deze afdichtingen zijn selectief ion-permeabel, afhankelijk van het weefsel en de samenstelling van de tight junction.
- Ten tweede:een op de twee claudins kan niet in strengen polymeriseren. Ze zijn afhankelijk van andere teamleden om een nauwe kruising te vormen en te "functionaliseren".
- Ten derde:Claudins werken met elkaar samen in vijf organisatieprincipes. Dit betekent dat er vijf verschillende manieren zijn waarop ze kunnen vermengen of scheiden.
Model maken voor medicijnontdekking
Het feit dat FMP-onderzoekers voor het eerst de organisatie van nauwe kruispunten op nanoschaal hebben kunnen bepalen, is een groot succes voor fundamenteel onderzoek. Maar ook de geneeskunde kan profiteren van de doorbraak. Dit komt omdat mutaties in claudines een rol spelen bij een aantal erfelijke ziekten, waarvan de meest voor de hand liggende het HELIX-syndroom is - een zeldzame aandoening die verminderde zweetproductie veroorzaakt.
Een mutatie in claudine 10b is de boosdoener, die hypohidrose en traan- en speekselklierdefecten veroorzaakt, evenals een verminderde calcium- en magnesiumregulatie in de nier. Het team van onderzoekers had ook geëxperimenteerd met deze ziektemutant.
"Ons onderzoek is nog lang niet klinisch relevant", verklaarde biofysicus Martin Lehmann, die hun bevindingen beoordeelde. "Maar nu begrijpen we tenminste hoe deze netwerken zijn gestructureerd. Dit is de eerste stap, die ons in staat zal stellen om te zoeken naar kleine moleculen die deze barrières openen of sluiten."
Celbioloog Hannes Gonschior voegde eraan toe dat ze "een vereenvoudigd model voor het ontdekken van geneesmiddelen hebben gevonden en, meer in het algemeen, onderzoek hebben gedaan naar de paracellulaire passage van ionen. Het is zeer waarschijnlijk dat onze bevindingen ons in staat zullen stellen om voorheen onverklaarde klinische fenotypes en symptomen te begrijpen - met een defect in een van deze specifieke paracellulaire barrières." + Verder verkennen
De kloof dichten:een tweeledig mechanisme voor epitheliale barrière
 Hoe metalen samenwerken om sterke stikstof-stikstofbindingen te verzwakken
Hoe metalen samenwerken om sterke stikstof-stikstofbindingen te verzwakken Multifunctionele katalysator voor gifbestendige waterstofbrandstofcellen
Multifunctionele katalysator voor gifbestendige waterstofbrandstofcellen Vooruitgang van elektrolyse bij hoge temperatuur:water splitsen om energie op te slaan als waterstof
Vooruitgang van elektrolyse bij hoge temperatuur:water splitsen om energie op te slaan als waterstof Onder druk:eiwit-nabootsende moleculen manipuleren met hydrostatische druk
Onder druk:eiwit-nabootsende moleculen manipuleren met hydrostatische druk Onderzoek levert potentiële bioblendstock op voor dieselbrandstof
Onderzoek levert potentiële bioblendstock op voor dieselbrandstof
 Het PhenoCam-netwerk maakt gebruik van big data om de impact van een warmer klimaat op de productiviteit van ecosystemen en koolstofcycli te voorspellen
Het PhenoCam-netwerk maakt gebruik van big data om de impact van een warmer klimaat op de productiviteit van ecosystemen en koolstofcycli te voorspellen Nowcasting strandwaterkwaliteit
Nowcasting strandwaterkwaliteit Klimaatopwarming belooft vaker extreme El Niño-evenementen
Klimaatopwarming belooft vaker extreme El Niño-evenementen Slechts 25 megasteden produceren 52% van 's werelds stedelijke uitstoot van broeikasgassen
Slechts 25 megasteden produceren 52% van 's werelds stedelijke uitstoot van broeikasgassen Bugs identificeren die hun huid afwerpen
Bugs identificeren die hun huid afwerpen
Hoofdlijnen
- Opinie:het wegen van in het laboratorium gekweekte biefstuk - de problemen met het eten van vlees zijn geen Silicon Valleys om op te lossen
- De functie van Peyers-patches
- Vogels zonder eigen broed helpen andere vogels met opvoeden, maar niet onbaatzuchtig
- De majestueuze orchidee uit Singapore genoemd ter ere van koningin Elizabeth
- Waar bevindt het DNA zich in een cel?
- Warmere aarde kan kleinere vlinders zien die moeite hebben om te vliegen, waardoor voedselsystemen worden aangetast
- Wat is sterker:nature of nurture?
- Wetenschappers roepen op tot actie om invasieve boomsoort aan te pakken
- Structureel en mechanisch inzicht in DNA-reparatie
- Honingraatstructuur met zuurstofarme poriën gevonden in oxideschaal op kleine, op lood gebaseerde reactormaterialen

- Wetenschappers onthullen dynamische koppeling van sterke waterstofbrug
- Nicotines houden vast:wat hebben de darmen en het geslacht ermee te maken?
- Hexamere lanthanide-organische capsules met tertiaire structuur, opkomende functies
- De tijd is rijp! Een innovatieve contactloze methode voor het tijdig oogsten van zachtfruit
 Wat zijn de componenten van de atoomstructuur?
Wat zijn de componenten van de atoomstructuur?  Hoe de luchtstroom en de statische drukval door de grill te berekenen
Hoe de luchtstroom en de statische drukval door de grill te berekenen  Wat er te weten valt over de watervoerende lagen in Zuid-Afrika
Wat er te weten valt over de watervoerende lagen in Zuid-Afrika Smartphone-advertentieanalysator creëert individuele voetafdruk voor analyse van advertentiebereik
Smartphone-advertentieanalysator creëert individuele voetafdruk voor analyse van advertentiebereik SpaceX's eerste lancering sinds raketontploffing is nu verschoven naar januari
SpaceX's eerste lancering sinds raketontploffing is nu verschoven naar januari Informatie over koolstofvoetafdruk voor kinderen
Informatie over koolstofvoetafdruk voor kinderen  DNA-onderzoek werpt nieuw licht op de mensen van de neolithische strijdbijlcultuur
DNA-onderzoek werpt nieuw licht op de mensen van de neolithische strijdbijlcultuur Zes afhaalrestaurants van Facebook-CEO Mark Zuckerbergs Senaatsverklaring over datalekken
Zes afhaalrestaurants van Facebook-CEO Mark Zuckerbergs Senaatsverklaring over datalekken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

