
Wetenschap
Lichtgevoelige trigger ontwikkeld voor de geprogrammeerde celdeling en dood
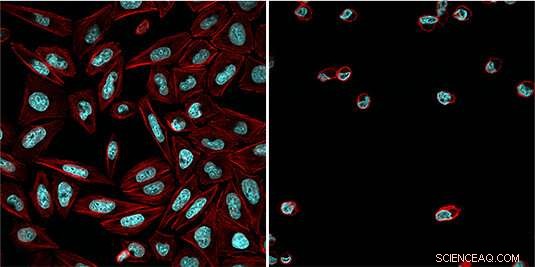
Cellen die zijn behandeld met de lichtafhankelijke remmer (actinecytoskelet in rood, DNA in blauw) na blootstelling aan blauw licht (rechts) en zonder activering van blauwlichtstraling (links). Krediet:Esther Zanin
Onderzoekers van de Ludwig Maximilian University hebben een lichtgevoelige remmer ontworpen die celdeling en celdood kan beheersen - en biedt een veelbelovende benadering voor studies van essentiële cellulaire processen en de ontwikkeling van nieuwe tumortherapieën.
Het vermogen om biologische en chemische processen nauwkeurig te beheersen is een essentieel onderdeel van zowel fundamenteel onderzoek als geneeskunde. Licht is daarbij een aantrekkelijke stimulans, omdat de effecten ervan zowel ruimtelijk als temporeel nauwkeurig kunnen worden gemoduleerd. Deze gewenste eigenschappen zijn de reden waarom de ontwikkeling van licht-controleerbare moleculen zo'n belangrijk doel is geworden voor biologische chemici. Dergelijke instrumenten beloven een belangrijke bijdrage te leveren aan de opheldering van elementaire cellulaire functies, het gedetailleerde begrip van medische aandoeningen en het ontwerpen van nieuwe therapeutische strategieën om ze te bestrijden. Een groep onderzoekers onder leiding van celbioloog Esther Zanin van LMU's Biocenter, in samenwerking met de chemicus Henry Dube (die in april van dit jaar verhuisde van de LMU naar de Universiteit van Erlangen-Nürnberg) heeft nu een lichtgevoelige chemische remmer ontwikkeld, waarmee ze twee fundamentele cellulaire processen kunnen controleren, celdeling en celdood, met licht.
Celdeling is een vitaal en zeer complex proces. Het is daarom onderworpen aan strikte regelgeving om ervoor te zorgen dat cellen zich alleen op het juiste moment en zonder fouten delen. Defecte cellen worden geëlimineerd door geprogrammeerde celdood (ook bekend als "apoptose"). Zowel de juiste celdeling als de verwijdering van defecte cellen zijn afhankelijk van een moleculaire machine die het proteasoom wordt genoemd. die specifiek cellulaire eiwitten afbreekt die ofwel beschadigd zijn of niet langer nodig zijn.
"We hebben nu een gevestigde en veelzijdige chemische remmer van het proteosoom aangepast door er een lichtgevoelige beschermende groep aan toe te voegen, ", zegt Zanin. "Deze groep blokkeert de reactieve aldehydefunctie van de remmer en voorkomt dat deze zich aan het proteasoom bindt." de remmer is daarom inactief en het proteasoom functioneert normaal. Echter, blootstelling van de cellen aan blauw licht maakt de beschermende groep los, waardoor de remmer kan interageren met het proteosoom en de functie ervan remmen. Omdat de activerende blauwlichtstraling nauwkeurig kan worden gericht, de werking van de remmer kan zeer nauwkeurig worden gecontroleerd. "Hierdoor, we zijn in staat om de deling van tumorcellen in een bepaald stadium van het proces te stoppen, en om apoptose gericht op gang te brengen, ' legt Zanin uit.
Zij en haar collega's zijn van mening dat de nieuwe lichtgevoelige proteosoomremmer een waardevol hulpmiddel zal blijken te zijn voor de studie van een breed scala aan dynamische cellulaire processen, bijvoorbeeld in het kader van ontwikkeling, waarbij cellen en weefsels in korte tijd en op beperkte locaties snelle en vaak ingrijpende veranderingen ondergaan. In aanvulling, proteosoomremmers hebben veelbelovende toepassingen als therapeutische middelen - bij de behandeling van kanker, bijvoorbeeld. "Het vermogen om deze verbindingen specifiek in zowel tijd als ruimte te activeren, zou ze in de toekomst effectiever kunnen maken, terwijl de incidentie van bijwerkingen wordt verminderd, " zegt Zanin. Echter, het bereiken van dit doel zal nog meer werk vergen, aangezien de in de nieuwe studie gebruikte remmer niet geschikt is voor medisch gebruik in zijn huidige vorm.
Hoofdlijnen
- Wat doet de Nucleolus in interfase?
- Technologie verhoogt melkgift met 9 procent
- Sterven mensen in politiehechtenis aan opgewonden delirium?
- Nieuw onderzoek lost een van de meest verhitte geschillen over evolutionaire biologie op robuuste wijze op
- De nadelen van biotechnologie
- Het verschil tussen genomisch DNA en plasmide-DNA
- Baby bongo geboren, waarschijnlijk binnenkort in Species Survival Center
- Afkoelend klimaat dreef de evolutie van de Tasmaanse duivel en zijn verwanten
- Genetisch manipulatiemechanisme gevisualiseerd
- Ideeën voor schoolreizen voor de middelbare school Scheikunde

- Een toekomst van behulpzame engineered living machines?

- Polymeerprofessor ontwikkelt veiliger onderdeel voor lithiumbatterijen

- Veelzijdige chemoproteomische probes voor op activiteit gebaseerde eiwitprofilering

- Molecuul vliegsnelheid voor het opsporen van drugs

 Hoe de atmosfeer de aarde beschermt
Hoe de atmosfeer de aarde beschermt Kan een stad ooit echt CO2-neutraal zijn?
Kan een stad ooit echt CO2-neutraal zijn? Hier is methaan:wetenschappers onderzoeken de oorsprong van een gapende permafrostkrater
Hier is methaan:wetenschappers onderzoeken de oorsprong van een gapende permafrostkrater Door smog getroffen Delhi annuleert oneven-even rantsoeneringsplan voor auto's
Door smog getroffen Delhi annuleert oneven-even rantsoeneringsplan voor auto's Experts benadrukken geavanceerde satellietgegevens als essentieel hulpmiddel bij het aanpakken van klimaatverandering
Experts benadrukken geavanceerde satellietgegevens als essentieel hulpmiddel bij het aanpakken van klimaatverandering Verhoogde interactie tussen neolithische migranten en jager-verzamelaars in West-Europa
Verhoogde interactie tussen neolithische migranten en jager-verzamelaars in West-Europa De omvang van het zee-ijs zakt naar recorddiepten aan beide polen
De omvang van het zee-ijs zakt naar recorddiepten aan beide polen Manieren om metaal te scheiden van Ore
Manieren om metaal te scheiden van Ore
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


