
Wetenschap
Chemici maken moleculaire scalpels om ongewenste eiwitten van celoppervlakken te verwijderen
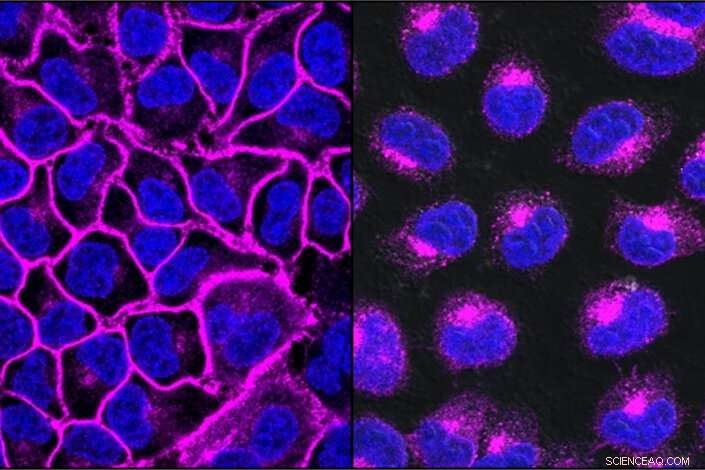
EGFR, een eiwit dat belangrijk is om kanker te helpen groeien, hier weergegeven in het paars, siert het celoppervlak (links). Na behandeling met een op EGFR gerichte LYTAC, al het EGFR-eiwit wordt naar de lysosomen getransporteerd, de afbraakcompartimenten in de cel (rechts). Krediet:Steven Banik
Wanneer wetenschappers een potentieel gevaarlijk eiwit op een cel vinden, ze kunnen zich voorstellen dat ze zichzelf inkrimpen om kleine chirurgen te worden, alleen het problematische molecuul wegsnijden en de gezonde delen van de cel intact laten. Terwijl behendige handen en scherpe instrumenten nooit in staat zouden zijn om een enkel eiwit van het oppervlak van een cel te verwijderen, een nieuw moleculair hulpmiddel zou cellulaire chirurgie gemakkelijker kunnen maken, volgens een studie gepubliceerd in Natuur op 29 juli.
Chemici van Stanford hebben een nieuwe klasse moleculen ontwikkeld die ongewenste eiwitten van het oppervlak of de omgeving van een cel naar het lysosoom transporteren. het cellulaire compartiment gewijd aan eiwitafbraak. Deze moleculen, genaamd lysosoom gericht op chimeren, of LYTAC's, werken door een eiwit selectief te taggen met een label dat zijn lot verzegelt voor verwijdering van celafval. Deze selectieve afbraak kan onderzoekers helpen bij het bestuderen en behandelen van ziekten zoals kanker en de ziekte van Alzheimer, waarvan de oorzaken verband houden met oppervlakte-eiwitten.
"Het is als een moleculair scalpel, " zei hoofdauteur Steven Banik, een postdoc in het lab van Carolyn Bertozzi, de Anne T. en Robert M. Bass Professor in de School of Humanities and Sciences. "Met deze tool kun je de natuurlijke afbraak van één individueel eiwit versnellen tussen alle verschillende eiwitten die zich op of buiten een cel bevinden."
Eiwitten zijn essentieel voor veel biologische processen zoals metabolisme en intercellulaire communicatie, maar sommige kunnen ook ziekten zoals kanker helpen verspreiden en immuunregulatie ontwijken. Traditionele methoden om deze slechte actoren te hinderen, omvatten het gebruik van medicijnen die de actieve plaats van het eiwit blokkeren, waar andere cellulaire componenten kunnen aanmeren terwijl het eiwit eraan gaat werken, meestal door atomen te verplaatsen. Maar deze blokkerende strategie is onvolmaakt; soms is de bindingszak te ondiep en springt de remmer er te snel uit. Andere tijden, de activiteit van een eiwit komt voort uit zijn fysieke eigenschappen, zoals zijn stijfheid, en niet van een actieve site, dus het blokkeren van een klein deel van het hele eiwit is onvoldoende. In deze gevallen, de cel van het eiwit aftappen is de enige optie.
Eiwitafbraak als therapeutische strategie is vooral populair sinds de ontwikkeling van PROTAC's, of proteolyse gericht op chimeren, 20 jaar geleden. PROTAC's, die intracellulaire eiwitten zoeken en labelen voor afbraak, succes hebben gezien in onderzoekslaboratoria en in vroege klinische studies, maar ze vertrouwen op een afbraakroute die ontoegankelijk is voor de ruwweg 40 procent van alle eiwitten die bovenop of buiten een celmembraan zitten. Bertozzi en Banik accepteerden niet dat bepaalde eiwitten - en ziekten - buiten bereik zouden zijn.
"Mijn lab is altijd geïnteresseerd geweest in wat er aan het celoppervlak gebeurt, die al deze eiwitten bevat die belangrijk zijn voor immuunmodulatie, zei Bertozzi, die ook de Baker Family Co-Director is van Stanford ChEM-H. "We hebben veel oppervlakte- en uitgescheiden eiwitten geïdentificeerd waarvan we denken dat ze een pathogene rol spelen bij kanker, en LYTAC's zouden ons kunnen helpen ze beter te begrijpen en ze te onderzoeken als doelwitten voor geneesmiddelen."
De sleutel tot het laten werken van de tool is het bifunctionele ontwerp. Eén kant van dit molecuul kan op maat worden gemaakt om te binden aan elk van belang zijnd eiwit. Aan de andere kant is een korte aminozuursequentie, of peptide, bezaaid met een suiker genaamd mannose-6-fosfaat.
Deze suiker dient als boekhoudkundig etiket voor de cel. Wanneer de cel eiwitten bouwt die in het lysosoom thuishoren, het kleeft aan deze suikers om ervoor te zorgen dat ze hun bestemming bereiken. "Mannose-6-fosfaat werkt als een postcode, " zei Banik. "Deze suikers vertellen de cel, 'Ik breng dit eiwit naar het lysosoom. Stuur me alsjeblieft daarheen.'" Er zijn receptoren op het celoppervlak die interageren met deze suikercoating, en wanneer ze een LYTAC-molecuul vastgrijpen en het de cel in trekken, de getagde eiwitten worden meegesleept.
Door dit label aan eiwitten te bevestigen, LYTAC's kapen een natuurlijk cellulair pendelmechanisme dat is ontworpen om nieuw gesynthetiseerde lysosomale eiwitten naar hun nieuwe huis te begeleiden. Maar terwijl lysosomale eiwitten sterk genoeg zijn om de afbrekende enzymen te overleven die ze in het lysosoom tegenkomen, de meeste eiwitten zijn dat niet, dus degenen die zijn getagd door de LYTAC-methode worden meestal vernietigd.
De Stanford-onderzoekers laten zien dat, in cellen, ze kunnen zich richten op eiwitten die belangrijk zijn bij de ziekte van Alzheimer en kanker en deze afbreken. Volgens hen, het eiwitbindende uiteinde van de LYTAC kan alles zijn dat aan een eiwit bindt, zoals een antilichaam of een bestaand medicijn, dus in de toekomst veel andere eiwitten en ziekten kunnen worden aangevallen.
"Met strategieën voor eiwitafbraak, je kunt niet alleen uitbreiden wat medicamenteus is, maar ook therapieën verbeteren die er al zijn, "zei Bertozzi. "Elke cel heeft lysosomen. Elke cel heeft al een manier om eiwitten af te breken. Wat je doel ook is, als je daar een LYTAC kunt krijgen, je kunt het degraderen."
 Wat sociale media ons kunnen leren over relaties tussen mens en omgeving
Wat sociale media ons kunnen leren over relaties tussen mens en omgeving 100 miljoen dode bomen in de Sierra vormen een enorm risico voor onvoorspelbare bosbranden
100 miljoen dode bomen in de Sierra vormen een enorm risico voor onvoorspelbare bosbranden Onderzoekers beweren dat langdurige blootstelling aan luchtvervuiling in China tussen 2000 en 2016 30,8 miljoen mensen heeft gedood
Onderzoekers beweren dat langdurige blootstelling aan luchtvervuiling in China tussen 2000 en 2016 30,8 miljoen mensen heeft gedood Bossen kunnen tegen 2050 van CO2-put naar bron veranderen
Bossen kunnen tegen 2050 van CO2-put naar bron veranderen NASA ziet tropische cycloon Ella ontstaan in de buurt van Fiji
NASA ziet tropische cycloon Ella ontstaan in de buurt van Fiji
Hoofdlijnen
- Namen van de Enzymen in de Mond & Esophagus
- Hoe de Galapagos-eilanden werken
- Nieuw type stamcellijn geproduceerd biedt uitgebreide mogelijkheden voor onderzoek en behandelingen
- Ontmoet Afrika's vogelmeester van vocale imitatie
- Noorse rechtbank verleent uitstel aan zeven wolven
- Stamcelplatform werpt nieuw licht op het begin van menselijke ontwikkeling
- Nieuw mechanisme wijst de weg naar het doorbreken van de antibioticaresistentie van ribosoom
- Duplicaties van niet-coderend DNA kunnen de evolutie van mensspecifieke eigenschappen hebben beïnvloed
- Handelen of niet handelen? De ivoren impasse doorbreken
- Kleine medicijnafgiftecapsules kunnen getransplanteerde insulineproducerende cellen ondersteunen
- Een groenere manier om ketonen te maken
- Chemici ontdekken hoe blauw licht blindheid versnelt

- Trucs om de Polyatomic Ions
- Schoonheid in imperfectie:hoe kristaldefecten kunnen helpen afvalwarmte om te zetten in elektriciteit
 Nikkelkatalysator vergemakkelijkt de creatie van een enkele stereo-isomeer met twee chirale centra
Nikkelkatalysator vergemakkelijkt de creatie van een enkele stereo-isomeer met twee chirale centra Een nieuwe film die zweet zes keer sneller verdampt en 15 keer meer vocht vasthoudt
Een nieuwe film die zweet zes keer sneller verdampt en 15 keer meer vocht vasthoudt Klimaatimpact van wolken gemaakt van vliegtuigcontrails kan tegen 2050 verdrievoudigen
Klimaatimpact van wolken gemaakt van vliegtuigcontrails kan tegen 2050 verdrievoudigen Amazones verhuizen zal buurten gentrificeren - tegen welke sociale kosten?
Amazones verhuizen zal buurten gentrificeren - tegen welke sociale kosten? Selenium maakt efficiëntere zonnecellen
Selenium maakt efficiëntere zonnecellen AI-methode bepaalt kwantumvoordeel voor geavanceerd computergebruik
AI-methode bepaalt kwantumvoordeel voor geavanceerd computergebruik Op zijn minst kan de opwarming van de aarde Amerikanen meer van de bank halen
Op zijn minst kan de opwarming van de aarde Amerikanen meer van de bank halen Natuurkundigen onderzoeken fundamentele limieten van kwantummotoren
Natuurkundigen onderzoeken fundamentele limieten van kwantummotoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

