
Wetenschap
SARS-CoV-2-enzym aanpakken met remmers
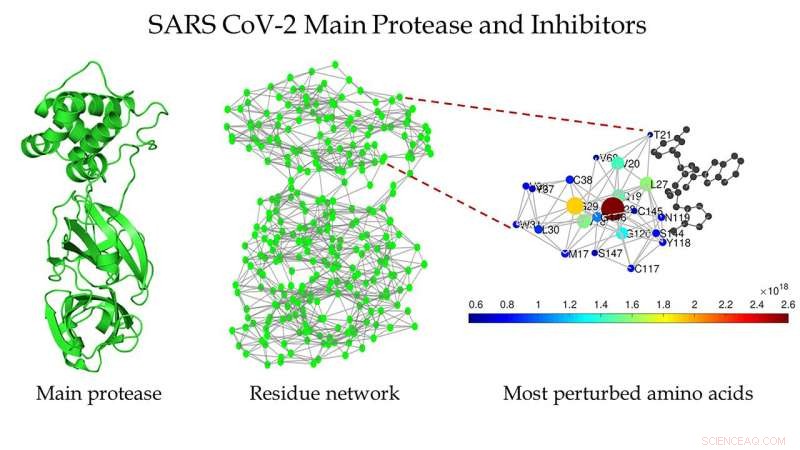
Schema van de belangrijkste protease van SARS CoV-2 (links), het eiwitresidunetwerk van het belangrijkste protease van SARS CoV-2 (midden), en een ingezoomde weergave van het gebied rond de bindingsplaats zoals gedetecteerd door Estrada (rechts). Krediet:Ernesto Estrada
Aangezien de COVID-19-pandemie, veroorzaakt door het coronavirus SARS-CoV-2, zich over de hele wereld blijft verspreiden, veel onderzoekers bestuderen epidemiologische modellen om de verspreiding ervan te voorspellen.
Echter, Ernesto Estrada, een wiskundige en expert in complexe systemen van de ARAID Foundation aan de Universiteit van Zaragoza, besloten zich te concentreren op het vinden van doelen binnen SARS-CoV-2 voor nieuwe medicijnen om aan te vallen. Van eerder werk, hij wist dat de belangrijkste protease van het virus, een enzym dat verantwoordelijk is voor de proteolytische verwerking van polyproteïnen, is een uitstekend doelwit.
In het journaal Chaos , Estrada zei toen hij en collega's een dramatische toename in de gevoeligheid van de belangrijkste protease van SARS-CoV-2 voor kleine verstoringen ontdekten, het deed hen vermoeden dat remmers een rol spelen bij het doden van het virus.
Remmers zijn organische moleculen, verdovende middelen, of nieuwe chemische verbindingen die zich hechten aan de bindingsplaats van een protease om zijn werk te remmen. Een virus zal sterven zonder dat een proteolytisch enzym ervoor werkt.
"Ik merkte dat scheikundigen al enkele krachtige remmers van het belangrijkste protease van SARS-CoV-2 hadden gevonden, en dat ze de structuur van dit eiwit hadden opgelost via röntgenkristallografie, " zei hij. "Het was schokkend om te zien dat dit protease erg lijkt op dat van het SARS-coronavirus, die de epidemieën van 2003 veroorzaakten, SARS-CoV-1."
Toen onderzoekers beide structuren over elkaar heen legden, ze kwamen bijna perfect overeen.
"Als je de aminozuursequenties van beide proteasen op een rij zet, er zijn slechts 12 van de 306 residuen die niet samenvallen, "Zei Estrada. "Is er iets verborgen achter deze schijnbare overeenkomsten tussen de twee proteasen? Kunnen we iets van hen leren om het ontwerp van medicijnen tegen het virus te verbeteren?"
De groep van Estrada heeft uitgebreide ervaring in de analyse van netwerken, zoals sociale netwerken, het internet, of voedselketens tussen soorten binnen een omgeving - en besloten een eiwit als netwerk te behandelen.
"Ze worden eiwitresidunetwerken genoemd, waar we elk aminozuur voorstellen als een knoop, en de interactie tussen twee aminozuren wordt weergegeven door een link tussen de twee, " hij legde uit.
Ze vonden verschillende structuren van de belangrijkste protease van SARS CoV-1 en SARS CoV-2 die schoon waren, wat betekent dat ze geen mutaties bevatten, liganden, of oplosmiddelen in hun structuren. Ze transformeerden hun structuur in eiwitresidunetwerken.
Estrada zei dat de meeste traditionele netwerkmetingen onthulden dat beide structuren erg op elkaar leken, iets wat zijn team al wist. "Maar een paar jaar geleden we hebben een meer geavanceerde wiskundige maatstaf ontwikkeld waarmee we kunnen detecteren hoe ver een verstoring binnen een netwerk kan worden voortgeplant. Dat werk was van een zeer theoretische, wiskundige aard, maar we hadden gespeculeerd dat het nuttig zou kunnen zijn voor de studie van eiwitten."
Dus hebben ze het op de proef gesteld. Het onthulde dat de protease van SARS-CoV-2 1 is, 900% gevoeliger voor de overdracht van verstoringen over lange afstand dan de protease van SARS-CoV-1.
"Dit betekent dat wanneer een eiwit wordt verstoord, bijvoorbeeld door water in de intracellulaire omgeving, dergelijke verstoringen worden overgedragen via een netwerk van intraresiduen die de 3D-structuur van het eiwit vormen, "Zei Estrada. "Als een dergelijke verstoring wordt geproduceerd rond een bepaald aminozuur in het protease van SARS-CoV-1, het wordt alleen overgedragen via een nauwe omgeving rond dat verstoorde aminozuur."
Maar als deze verstoring optreedt bij één aminozuur in het protease van SARS-CoV-2, het wordt doorgegeven aan bijna het hele netwerk, zelfs aan aminozuren die heel ver weg zijn.
"Het is opmerkelijk, omdat het betekent dat met kleine structurele verschillen de protease van SARS-CoV-2 veel effectiever is binnen intraresiducommunicatie, " Zei Estrada. "Het zou veel effectiever moeten zijn in het doen van zijn werk als proteolytisch enzym van het virus. De duivel deed het hier bijna perfect, maar hij liet de deur openstaan. Deze grote gevoeligheid van het SARS-CoV-2-protease voor verstoringen kan zijn achilleshiel zijn in relatie tot remmers."
De benadering van de groep kan worden gebruikt voor grootschalige screeningprotocollen om krachtige remmers van SARS-CoV-2-hoofdprotease te identificeren en, bijgevolg, voor de ontwikkeling van nieuwe medicijnen om het te doden.
 Hoe is een bruine kluizenaarspin als een samoeraienzwaardsmid?
Hoe is een bruine kluizenaarspin als een samoeraienzwaardsmid? Wat is een calorimeter en wat zijn zijn beperkingen?
Wat is een calorimeter en wat zijn zijn beperkingen?  Chaperones bereiden eiwitten gewoon voor om zelf te vouwen
Chaperones bereiden eiwitten gewoon voor om zelf te vouwen Sterker beton maken met staalslakken die zijn verrijkt met afvalwater
Sterker beton maken met staalslakken die zijn verrijkt met afvalwater Metaalkatalysatoren die worden gebruikt voor milieuduurzaamheid blijken te degraderen en worden minder effectief
Metaalkatalysatoren die worden gebruikt voor milieuduurzaamheid blijken te degraderen en worden minder effectief
 Hoe vulkanen de aardkorst recyclen om zeldzame metalen bloot te leggen die essentieel zijn voor groene technologie
Hoe vulkanen de aardkorst recyclen om zeldzame metalen bloot te leggen die essentieel zijn voor groene technologie El Nino-gekoppelde afname van bodemvocht kan leiden tot massale afsterving van tropische planten
El Nino-gekoppelde afname van bodemvocht kan leiden tot massale afsterving van tropische planten Toekomstige tsunami's mogelijk in de Rode Zee Golf van Elat-Aqaba
Toekomstige tsunami's mogelijk in de Rode Zee Golf van Elat-Aqaba Rapport vindt extra radioactief materiaal in boorgruis van gasbronnen
Rapport vindt extra radioactief materiaal in boorgruis van gasbronnen Geheimen van de grootste koolstofput op aarde onthuld door synchrotron-onderzoek
Geheimen van de grootste koolstofput op aarde onthuld door synchrotron-onderzoek
Hoofdlijnen
- Wetenschappers lokaliseren jaloezie in de monogame geest
- Een celmodel maken Styrofoam Ball
- Slangenmans gifgewoonte houdt hoop op nieuw tegengif
- Hoe een menselijke cel te maken voor een wetenschapsproject
- Koolwaterstofafbrekende schimmel geeft zijn geheimen prijs
- Embryonale ontwikkeling van een kikker
- Klimaatverandering:kunnen kolibries de hitte aan?
- Hoe levert embryologie bewijs voor evolutie?
- Zoogdier waarvan lang gedacht werd dat het uitgestorven was in Australië duikt weer op
- Nikkelkatalysator vergemakkelijkt de creatie van een enkele stereo-isomeer met twee chirale centra

- Chemici maken zelfassemblerend materiaal met een reeks nieuwe eigenschappen

- Nieuw ecologisch proces om goedkopere biobrandstof te produceren

- Nieuw protocol voor het meten van achtergrondniveaus van drugs in misdaadlabs

- Nieuwe elektroden kunnen de efficiëntie van elektrische voertuigen en vliegtuigen verhogen

 Hittestress in de VS kan tegen het einde van de eeuw verdubbelen
Hittestress in de VS kan tegen het einde van de eeuw verdubbelen Onderzoekers onthullen patronen van seksueel misbruik in religieuze omgevingen
Onderzoekers onthullen patronen van seksueel misbruik in religieuze omgevingen Nieuwe studie vindt dat de natuur van vitaal belang is om klimaatverandering te verslaan
Nieuwe studie vindt dat de natuur van vitaal belang is om klimaatverandering te verslaan Wetenschappers breken resolutierecords om individuele atomen te visualiseren met single-particle cryo-EM
Wetenschappers breken resolutierecords om individuele atomen te visualiseren met single-particle cryo-EM Nieuw materiaal maakt de weg vrij voor informatietechnologie van de volgende generatie
Nieuw materiaal maakt de weg vrij voor informatietechnologie van de volgende generatie Supersterke permanente magneten maken
Supersterke permanente magneten maken  Nieuwe studie in zuurstofarme Zwarte Zee geeft inzicht in toekomstig koolstofbudget
Nieuwe studie in zuurstofarme Zwarte Zee geeft inzicht in toekomstig koolstofbudget Anafase: wat gebeurt er in dit stadium van mitose en meiose?
Anafase: wat gebeurt er in dit stadium van mitose en meiose?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

