
Wetenschap
Wetenschappers breken resolutierecords om individuele atomen te visualiseren met single-particle cryo-EM
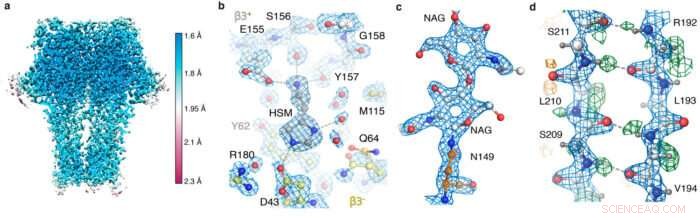
GABA EEN snapshots van de receptorkaart. (a) lokale afwikkeling; (b) de agonist-pocket die histamine-coördinatie en watermoleculen toont; (c) N-gebonden glycaan; (d) waterstofbindingsnetwerk onthuld door de verschilkaart (groene pieken).
Kijken naar de precieze driedimensionale rangschikking van atomen in een eiwit helpt ons te begrijpen hoe het zijn functies kan uitvoeren. Hoewel elektronencryomicroscopie (cryo-EM) zich de afgelopen jaren snel heeft ontwikkeld als een belangrijke structurele biologietechniek, Röntgenkristallografie was de enige techniek die individuele atomen kon visualiseren. Radu Aricescu's en Sjors Scheres' groepen bij het MRC Laboratory of Molecular Biology, in samenwerking met wetenschappers van Thermo Fisher Scientific en elders, hebben nu voor het eerst individuele eiwitatomen kunnen oplossen in een driedimensionaal cryo-EM-beeld.
Deze samenwerking begon begin 2019 toen Radu en Abhay Kotecha, een onderzoeker bij Thermo Fisher Scientific, wilde nieuwe cryo-EM-hardware testen op een klein membraaneiwitmonster. GABAA-receptoren, een focus van Radu's onderzoek voor meer dan een decennium, werden gekozen omdat de hoogst haalbare resolutie met behulp van de best beschikbare technologie een limiet leek te hebben bereikt van ongeveer 2,5 Ångströms (Å), maar een hogere resolutie was duidelijk nodig voor een beter medicijnontwerp.
Wat is atomaire resolutie?
Resolutie wordt meestal gerapporteerd in Ångströms, een lengte-eenheid die een tien miljardste van een meter of 0,1 nanometer is, en verwijst naar de kleinste afstand waartussen twee objecten als gescheiden kunnen worden gezien.
De lengte van een typische koolstof-koolstofbinding is 1,5; andere bindingen in eiwitten zijn iets korter. Dus, naarmate de resolutie daalt tot 1,2 Å, wordt het mogelijk om individuele atomen in een eiwit te zien, het bereiken van echte atomaire resolutie.
Tijdens het testen van nieuwe hardwareontwikkelingen, waaronder een koudeveldemissiekanon-elektronenbron, een nieuw energiefilter, en een nieuwe camera, het team moest ook nieuwe verwerkingsstrategieën ontwikkelen. Algoritmen voor de correctie van optische aberraties die eerder werden ontwikkeld door Jasenko Zivanov in de groep van Sjors, evenals een algoritme voorgesteld door Chris Russo en Richard Henderson, speelde een cruciale rol bij het persen van de meeste informatie uit de afbeeldingen.
Na ontvangst van beelden verzameld op de nieuwe microscoophardware door Abhay Kotecha bij Thermo Fisher Scientific in Eindhoven, Nederland, Takanori Nakane, een postdoc in de groep van Sjors, een optimale workflow ontwikkeld in RELION en Andrija Sente, samen met andere leden van Radu's groep, deze workflow gebruikt om GABAA-receptorbeelden te verwerken, terwijl u resultaten terugkoppelt om de microscoopinstellingen snel te optimaliseren. een nieuwe, Een dataopslagsysteem met hoge capaciteit, ontwikkeld door Jake Grimmett en Toby Darling in het Scientific Computing-team van de LMB, bood cruciale ondersteuning bij het verwerken van de ongeveer honderd terabytes aan gegenereerde gegevens. Deze aanhoudende teaminspanning leidde tot een ongekende GABAA-receptorstructuur met een resolutie van 1,7 A.
Dit was de best gerapporteerde resolutie die werd bereikt met behulp van cryo-EM voor elk ander eiwitmonster dan voor het eiwit apoferritine. Apoferritine wordt vaak gebruikt als maatstaf voor cryo-EM, omdat de moleculaire stabiliteit en 24-voudige symmetrie reconstructies met hoge resolutie van relatief weinig deeltjes mogelijk maken.
Met behulp van de nieuwe hardware en verwerkingsstrategieën, het team was in staat om een apoferritine-structuur met een resolutie van 1,22 Å te verkrijgen, het vorige record van 1,53 verslaan om de cryo-EM-structuur met de hoogste resolutie te zijn die tot nu toe is verkregen. Het meest indrukwekkend, deze resolutie maakte visualisatie van individuele waterstofatomen mogelijk, zelfs op watermoleculen in de eiwitstructuur. De visualisatie van waterstofbindingsnetwerken in eiwitstructuren en in medicijnbindende zakken stelt onderzoekers in staat beter te begrijpen hoe ze werken.
Dit werk vertegenwoordigt het doorbreken van een belangrijke barrière voor cryo-EM als een structurele biologietechniek en de nieuwe technologie, gegevensverzameling, en verwerkingsstrategieën zullen het aantal eiwitten waarvan de structuren kunnen worden opgelost, uitbreiden tot een hoge resolutie. Deze reconstructies met een hogere resolutie zullen een beter begrip mogelijk maken van hoe eiwitten werken en het ontwerp van meer specifieke medicijnen vergemakkelijken die van invloed kunnen zijn op behandelingen voor een groot aantal ziekten.
 Duurzaamheid belangrijk voor internationale toeristen - nieuw onderzoek
Duurzaamheid belangrijk voor internationale toeristen - nieuw onderzoek Stapsgewijze verandering in energie-investeringen nodig om klimaatdoelen te halen:IEA
Stapsgewijze verandering in energie-investeringen nodig om klimaatdoelen te halen:IEA Een blik op 377 metro's:kunnen lokale voedselproducten voldoen aan de lokale vraag van huishoudens?
Een blik op 377 metro's:kunnen lokale voedselproducten voldoen aan de lokale vraag van huishoudens? Jonge boeren in Californië vinden nieuwe manieren om vee te fokken en het land te verbeteren
Jonge boeren in Californië vinden nieuwe manieren om vee te fokken en het land te verbeteren Tsunami stelde honderden waterdieren in staat om over de Stille Oceaan te raften
Tsunami stelde honderden waterdieren in staat om over de Stille Oceaan te raften
Hoofdlijnen
- Hoe de Amoeben zich reproduceren?
- Wat betekent Kaukasisch echt?
- Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong
- E. Coli kweken in een petrischaal
- De bergleeuw in de wijk San Francisco is verdoofd
- Wat is de Chromatins-functie?
- Zes soorten neuroglia
- Nieuw onderzoek benadrukt de noodzaak om te leren van klimaatveranderingen uit het verleden
- De vergeten wetenschapper die de weg vrijmaakte voor de ontdekking van de DNA-structuur
- Nanodunne piëzo-elektriciteit bevordert zelfaangedreven elektronica
- DIO-additieven dragen bij aan efficiëntie van polymere zonnecellen
- Nanomateriaaltheorie beschrijft sterk gecorreleerde elektronen in kwantumstippen
- Elektronenverdelingsproces in grafeen waargenomen, een wereldprimeur
- Het ontsluiten van melkformule kan levens redden, zeggen wetenschappers

 Wolkenkrabbers van de toekomst kunnen van hout worden gemaakt
Wolkenkrabbers van de toekomst kunnen van hout worden gemaakt  Hoe droogte de watervoorziening in de hoofdsteden van Australië beïnvloedt
Hoe droogte de watervoorziening in de hoofdsteden van Australië beïnvloedt Schattingen van emissies van aardgasgestookte centrales veel te laag, studie vondsten
Schattingen van emissies van aardgasgestookte centrales veel te laag, studie vondsten De verborgen geheimen van het maken van een virale YouTube-advertentie
De verborgen geheimen van het maken van een virale YouTube-advertentie Hoe een Grade Point Average te berekenen voor 5.0
Hoe een Grade Point Average te berekenen voor 5.0  Enge opwarming bij palen die op rare tijden verschijnen, plaatsen
Enge opwarming bij palen die op rare tijden verschijnen, plaatsen Wereldwijde verviervoudiging van koelapparatuur tot 14 miljard in 2050
Wereldwijde verviervoudiging van koelapparatuur tot 14 miljard in 2050 Groot geologisch onderzoek hoopt Indonesië beter bestand te maken tegen dodelijke tsunami's
Groot geologisch onderzoek hoopt Indonesië beter bestand te maken tegen dodelijke tsunami's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

