
Wetenschap
Chaperones bereiden eiwitten gewoon voor om zelf te vouwen
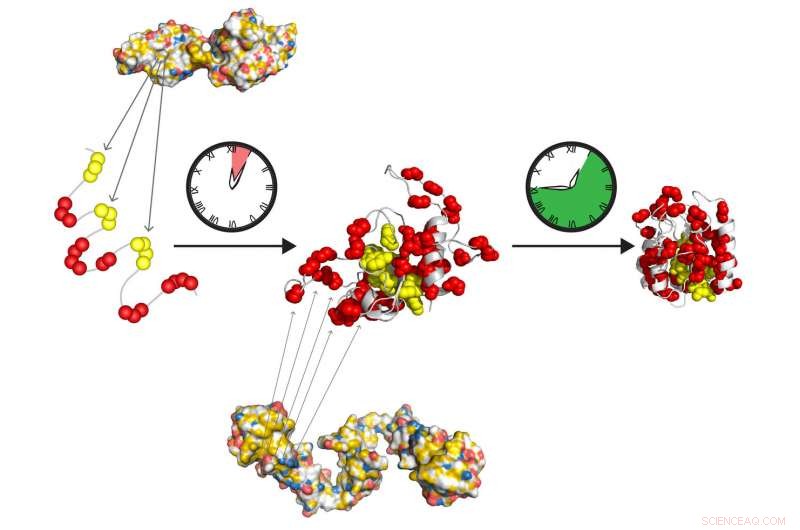
De moleculaire chaperonnes Hsp70 en Hsp90 vormen een snelwerkend relaisteam om eiwitten voor te bereiden om zelfstandig in hun actieve staat te vouwen. Hsp70 herkent korte hydrofobe rekken (geel), blootgesteld in het ongevouwen eiwit. Hsp90 werkt stroomafwaarts van Hsp70 en vergemakkelijkt het vormen van het vouwende tussenproduct, die langzaam overgaat in de oorspronkelijke staat, vrij van verdere chaperonne-acties. Krediet:Tania Morán Luengo en Stefan Rüdiger, Universiteit Utrecht
Cellulaire eiwitten worden geproduceerd als lange ketens van aminozuren die zich precies in hun uiteindelijke vorm moeten vouwen. De hoofdrolspelers in dit vouwproces zijn de zogenaamde moleculaire chaperonnes, eiwithelpers die ervoor zorgen dat dit proces succesvol is. Onderzoekers van de Universiteit Utrecht, in nauwe samenwerking met collega's van de Universiteit van Heidelberg, hebben eindelijk ontdekt hoe de twee belangrijkste chaperonne-families, Hsp70 en Hsp90, meewerken aan dit vouwproces. Verrassend genoeg, het blijkt dat ze niet actief helpen bij het vouwen, zoals wetenschappers lang hadden aangenomen. In plaats daarvan, ze bereiden de eiwitten gewoon voor op spontane, productief vouwen. Deze doorbraak in het begrijpen van de werking van de Hsp70-Hsp90-cascade zal worden gepubliceerd in Moleculaire cel op 3 mei.
Verkeerd gevouwen eiwitten kunnen leiden tot ernstige ziekten zoals cystische fibrose en veel neurodegeneratieve ziekten zoals de ziekte van Alzheimer. Wetenschappers weten al lang dat Hsp70 en Hsp90 een sleutelrol spelen in dit vouwproces, en dat Hsp90 stroomafwaarts van Hsp70 werkt. Echter, het eigenlijke mechanisme waarmee ze een eiwit vouwen is raadselachtig gebleven.
doctoraat kandidaat Tania Morán Luengo van de Universiteit Utrecht heeft onlangs aangetoond dat de chaperonne Hsp70 zich bindt aan het jonge eiwit, om het te beschermen en tegelijkertijd te voorkomen dat het vouwt. Dan breekt Hsp90 het Hsp70-blok, waardoor het eiwit vanzelf in de juiste staat kan blijven vouwen. Deze ontdekking betekende het verrassende einde van de al lang bestaande overtuiging dat chaperonnes eiwitten vouwen.
Onderzoeksleider Dr. Stefan Rüdiger van de Universiteit Utrecht kreeg een glimp van dit nieuwe idee terwijl hij zich voorbereidde om een cursus over het onderwerp te geven. Hsp70 bindt aan hydrofobe aminozuren, ze beschermen tegen aan elkaar plakken totdat ze zijn verborgen in de uiteindelijke eiwitstructuur. Hij realiseerde zich dat de manier waarop Hsp70 zich bindt aan zijn substraten daarom niet kon bijdragen aan eiwitvouwing, maar remt het eerder.
De onderzoekers gingen vervolgens aan de slag om het vouwproces te analyseren, observeren dat concentraties van Hsp70 in het bereik van die in onze cellen de eiwitvouwing remden. "Hieruit werd afgeleid dat Hsp70 geen promotor is, maar in feite een effectieve remmer van het vouwproces, " Rüdiger legt uit. Zijn groep werkte samen met het laboratorium van Prof. Matthias Mayer aan de Universiteit van Heidelberg om deze hypothese experimenteel te testen. Ze toonden aan dat de aanwezigheid van Hsp90 op dit punt cruciaal is voor het vouwproces. Hsp90 zorgt ervoor dat het eiwit kan breken uit de Hsp70-impasse om vanzelf in de juiste vorm te vouwen.
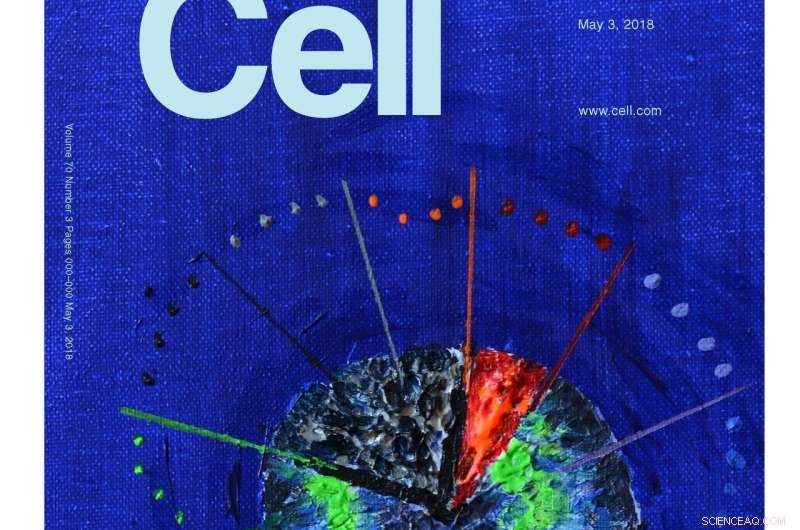
Molecular Cell koos voor de omslag een illustratie van dit onderzoek. Het artwork is gemaakt door onderzoeksleider Stefan Rüdiger (acryl op canvas). Het geeft aan dat de geconserveerde Hsp70 en Hsp90 chaperonnes een cascade vormen die alleen actief is in de eerste, gloeiend hete minuten van het vouwproces. De daaropvolgende passage door het pad naar de oorspronkelijke staat is lang en langzaam - en vrij van inmenging van begeleiders. Krediet:Moleculaire cel / Stefan Rüdiger, Universiteit Utrecht
"Dit stop-startmechanisme is geconserveerd van bacteriën tot de mens, " zegt Rüdiger. "Veel ziekten zijn afhankelijk van de uiteindelijke actieve vorm van eiwitten. Dus, onderzoekers die werken aan therapieën die gericht zijn op het vouwproces, weten eindelijk waar ze op moeten letten."
 Mexico's waarschuwingssysteem speelt zijn rol als aardbeving toeslaat
Mexico's waarschuwingssysteem speelt zijn rol als aardbeving toeslaat NASA vindt tropische storm Matmo voor de kust van Vietnam
NASA vindt tropische storm Matmo voor de kust van Vietnam Blijvend schoon drinkwater voor mensen in sloppenwijken
Blijvend schoon drinkwater voor mensen in sloppenwijken Seismische activiteit van de alpiene breuk in Nieuw-Zeeland complexer dan vermoed
Seismische activiteit van de alpiene breuk in Nieuw-Zeeland complexer dan vermoed Rivieren hebben niet dezelfde rechten als mensen:India's hoogste rechtbank
Rivieren hebben niet dezelfde rechten als mensen:India's hoogste rechtbank
Hoofdlijnen
- Vergelijking voor glucosemetabolisme
- Gaan we de zesde grote uitsterving op aarde in?
- Voor deze baleinwalvissen, jagen vereist weinig meer dan watertrappelen
- Kan glucose door het celmembraan diffunderen door eenvoudige diffusie?
- Walviskarkas opgegraven van Australisch strand vanwege angst voor haaien
- De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen
- Evidence of Evolution: The Origin of Plants, Animals & Fungi
- Haaien spotten drones op patrouille op Australische stranden
- Doorbreken van peulvruchten gewas wilde relatieve barrière
- Comet inspireert chemie voor het maken van ademende zuurstof op Mars

- Nieuwe microscooptechniek onthult interne structuur van levende embryo's
- Nieuwe zouten leggen de lat hoger voor lithium-ionbatterijtechnologie

- Onderzoekers gebruiken 3D-printen om metallische glaslegeringen in bulk te maken

- CO2 omzetten om duurzame energie op te slaan

 Biotische factoren van het regenwoud
Biotische factoren van het regenwoud In een eerste, onderzoekers identificeren roodachtige kleuren in een oud fossiel
In een eerste, onderzoekers identificeren roodachtige kleuren in een oud fossiel Hoe te meten met een mL-spuit
Hoe te meten met een mL-spuit  Meer ondersteuning voor Planet Nine
Meer ondersteuning voor Planet Nine Bio-geïnspireerd gelmateriaal kan ingenieurs helpen de bewegingen van zachte robots te beheersen
Bio-geïnspireerd gelmateriaal kan ingenieurs helpen de bewegingen van zachte robots te beheersen Een mijlpaal voor het voorspellen van aardbevingsgevaren
Een mijlpaal voor het voorspellen van aardbevingsgevaren De rol van Coenzymes
De rol van Coenzymes Blue Origin zal in juli de eerste bemanning naar de ruimte vliegen
Blue Origin zal in juli de eerste bemanning naar de ruimte vliegen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

