
Wetenschap
Het periodiek systeem begrijpen door de lens van de vluchtige Groep I metalen
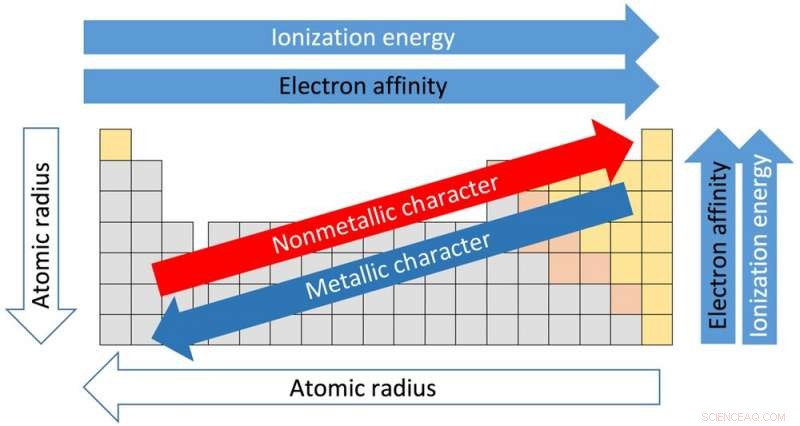
Trends van het periodiek systeem. Krediet:Sandbh/Wikipedia, CC BY-SA
Het nieuws brak dat een treinwagon, geladen met zuiver natrium, was net ontspoord en morste de inhoud ervan. Een televisiereporter belde me om uit te leggen waarom brandweerlieden geen water mochten gebruiken op de vlammen die uit de verminkte auto barsten. Terwijl ik in de lucht was, voegde ik wat natrium toe aan een beetje water in een petrischaal en we observeerden de vicieuze reactie. Voor nog meer dramatisch effect, Ik deed ook wat kalium in water en verbaasde iedereen met de explosieve blauwachtige vlammen.
Omdat Groep I metalen, ook bekend als alkalimetalen, zijn zeer reactief, zoals het natrium uit de treinwagon of het kalium, ze komen niet in zuivere vorm in de natuur voor, maar alleen als zouten. Ze zijn niet alleen zeer reactief, ze zijn zacht en glanzend, kunnen gemakkelijk worden gesneden, zelfs met een bot mes en zijn de meest metaalachtige van alle bekende elementen.
Ik ben een chemicus die zijn carrière heeft besteed aan het bouwen van nieuwe moleculen, soms met behulp van Groep I-elementen. Door het gedrag en de trends van Groep I-elementen te bestuderen, we kunnen een glimp opvangen van hoe het periodiek systeem is gerangschikt en hoe het moet worden geïnterpreteerd.
De basis
De rangschikking van het periodiek systeem en de eigenschappen van elk element daarin is gebaseerd op het atoomnummer en de rangschikking van de elektronen die rond de kern draaien. Het atoomnummer beschrijft het aantal protonen in de kern van het element. Het atoomnummer van waterstof is 1, helium is 2, lithium is 3 enzovoort.
Elk van de 18 kolommen in de tabel wordt een groep of een familie genoemd. Elementen in dezelfde groep delen vergelijkbare eigenschappen. En de eigenschappen kunnen worden aangenomen op basis van de locatie binnen de groep. Gaande van de top van groep I naar de bodem, bijvoorbeeld, de atoomstralen – de afstand van de kern tot de buitenste elektronen – nemen toe. Maar de hoeveelheid energie die nodig is om een buitenste elektron af te scheuren, neemt af van boven naar beneden, omdat de elektronen verder van de kern zijn en niet zo stevig worden vastgehouden.
Dit is belangrijk omdat hoe elementen op elkaar inwerken en met elkaar reageren, afhangt van hun vermogen om elektronen te verliezen en te winnen om nieuwe verbindingen te maken.
De horizontale rijen van de tabel worden perioden genoemd. Bewegend van de linkerkant van de periode naar rechts, de atoomstraal wordt kleiner omdat elk element één extra proton en één extra elektron heeft. Meer protonen betekent dat elektronen strakker naar de kern worden getrokken. Om dezelfde reden neemt de elektronegativiteit - de mate waarin een element de neiging heeft om elektronen te winnen - van links naar rechts toe.
De kracht die nodig is om het buitenste elektron te verwijderen, bekend als de ionisatiepotentiaal, neemt ook toe vanaf de linkerkant van de tafel, die elementen heeft met een metaalachtig karakter, naar de rechterkant, die niet-metalen zijn.
Elektronegativiteit neemt af van de bovenkant van de kolom naar de onderkant. Het smeltpunt van de elementen binnen een groep neemt ook af van de bovenkant naar de onderkant van een groep.
De basis toepassen op Groep I-elementen
Zoals de naam al aangeeft, Groep I-elementen bezetten de eerste kolom in het periodiek systeem. Elk element begint een nieuwe periode. Lithium staat aan de top van de groep en wordt gevolgd door natrium, geen; potassium, K; rubidium, Rb; cesium, Cs en eindigt met de radioactieve francium, NS. Omdat het zeer radioactief is, vrijwel geen chemie wordt uitgevoerd met dit element.
Omdat elk element in deze kolom een enkel buitenste elektron in een nieuwe schil heeft, de volumes van deze elementen zijn groot en nemen dramatisch toe wanneer ze van de top naar de onderkant van de groep gaan.
Van alle Groep I-elementen, cesium heeft de grootste volumes omdat het buitenste enkele elektron losjes wordt vastgehouden.
Ondanks deze tendensen, de eigenschappen van de elementen van Groep I lijken meer op elkaar dan die van enige andere groep.
Alkalimetalen door de geschiedenis
Met behulp van chemische eigenschappen als zijn gids, De Russische chemicus Dimitri Mendelejev bestelde de eerste Groep I-elementen correct in zijn periodiek systeem van 1869. Het wordt periodiek genoemd omdat elk achtste element de eigenschappen herhaalt van het element erboven in de tabel. Na het rangschikken van alle toen bekende elementen, Mendelejev nam de gewaagde stap om lege plekken achter te laten waar zijn extrapolatie van chemische eigenschappen aantoonde dat een element zou moeten bestaan. De daaropvolgende ontdekking van deze nieuwe elementen bewees dat zijn voorspelling juist was.
Sommige alkalimetalen waren al bekend en werden goed gebruikt lang voordat Mendelejev het periodiek systeem maakte. Bijvoorbeeld, het Oude Testament noemt zout - een combinatie van het alkalimetaal natrium met chloor - 31 keer. Het Nieuwe Testament verwijst er 10 keer naar en noemt natriumcarbonaat "neter" en kaliumnitraat "salpeter".
Mensen weten al sinds de oudheid dat houtas een kaliumzout produceert dat, in combinatie met dierlijk vet, zeep zal opleveren. Samuel Hopkins verkreeg het eerste Amerikaanse patent op 31 juli, 1790, voor zeep onder het nieuwe octrooistatuut dat net een paar maanden eerder door president George Washington is ondertekend.
De pyrotechnische industrie houdt van deze Groep I-elementen vanwege hun levendige kleuren en explosieve karakter. Het branden van lithium produceert een levendige karmozijnrode kleur; natrium een gele; kalium sering; rubidium rood; en cesiumviolet. Deze kleuren worden geproduceerd wanneer elektronen vanuit hun thuisomgeving in een baan om de kern springen en weer terugkeren.
De cesium-atoomklok, het meest nauwkeurige uurwerk ooit ontwikkeld, functies door de frequentie te meten van cesiumelektronen die heen en weer springen tussen energietoestanden. Klokken gebaseerd op het springen van elektronen bieden een uiterst nauwkeurige manier om seconden te tellen.
Andere toepassingen zijn onder meer natriumdamplampen en lithiumbatterijen.
In mijn eigen onderzoek heb ik Groep I-metalen gebruikt als gereedschap om andere scheikunde uit te voeren. Ooit had ik behoefte aan absoluut droge alcohol, en de droogste die ik kon kopen bevatte nog minuscule sporen van water. De enige manier om het laatste restje water kwijt te raken was door de waterhoudende alcohol te behandelen met natrium - een nogal dramatische manier om water te verwijderen.
De alkali-elementen bezetten niet alleen de eerste kolom in het periodiek systeem, maar ze vertonen ook de meeste reactiviteit van alle groepen in de hele tabel en hebben de meest dramatische trends in volume en ionisatiepotentieel, terwijl ze onderling grote gelijkenissen behouden.
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 Gebruik van geradicaliseerde NOₓ-derivaten op metaaloxiden
Gebruik van geradicaliseerde NOₓ-derivaten op metaaloxiden Onderzoekers passen katalysatoren aan om productopbrengsten te verhogen, verlaag de scheidingskosten
Onderzoekers passen katalysatoren aan om productopbrengsten te verhogen, verlaag de scheidingskosten Wat is de functie van een Tris-buffer in DNA-extractie?
Wat is de functie van een Tris-buffer in DNA-extractie?
Tris, of tris (hydroxymethyl) aminomethaan, is een algemene biologische buffer die tijdens het gehele DNA-extractieproces wordt gebruikt. Tijdens extractie uit een willekeurig aantal bronnen i
 Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen
Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen Langdurige pijnverlichting met MOF's
Langdurige pijnverlichting met MOF's
 Alomtegenwoordige effecten van menselijke impact op het landschap van Engeland onthuld
Alomtegenwoordige effecten van menselijke impact op het landschap van Engeland onthuld Krachtige cycloon komt aan land in India
Krachtige cycloon komt aan land in India Het klimaatwetenschappelijk rapport dat Trump hoopte te negeren, zal weerklank vinden buiten Washington, gelijkstroom
Het klimaatwetenschappelijk rapport dat Trump hoopte te negeren, zal weerklank vinden buiten Washington, gelijkstroom Zee-ijs op polen bereikt laagterecord voor januari
Zee-ijs op polen bereikt laagterecord voor januari Hawaï-onderzoekers ontvangen geld om koraalziekte in de Stille Oceaan te voorspellen
Hawaï-onderzoekers ontvangen geld om koraalziekte in de Stille Oceaan te voorspellen
Hoofdlijnen
- Iraakse dierenliefhebbers gaan online om zwerfdieren in Bagdad te redden
- Binaire splijting: definitie & proces
- Ervaren dieren geluk?
- Hoe afnemende zoogdierpopulaties in de Florida Everglades verband houden met de invasieve Birmese python
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Biologische leeftijd verklaart variatie in reacties op stress
- Hoe een 3D-diercelmodel te maken
- Onderzoekers ontdekken dat het nauwkeurig transcriberen van DNA het herstel van DNA opheft
- Wat zijn drie primaire doelen van mitose?
- Gezonde organellen, gezonde cellen

- Verfijning van thermo-elektrische materialen voor goedkopere hernieuwbare energie

- Wetenschappers ontwikkelen een innovatieve methode voor het vullen en afdichten van pleuraholtes

- Een nieuw soort plastic dat zijn oorspronkelijke eigenschappen behoudt bij recycling

- Classic Science at Home: Elephant Toothpaste

 Probeer je de drang om uit te geven te weerstaan? Dump de smartphone
Probeer je de drang om uit te geven te weerstaan? Dump de smartphone Onderzoek inspecteert een eigenaardige eruptieve jonge ster
Onderzoek inspecteert een eigenaardige eruptieve jonge ster Wereldwijde ISA-dynamiek waargenomen door Landsat-satellieten van 1972 tot 2019
Wereldwijde ISA-dynamiek waargenomen door Landsat-satellieten van 1972 tot 2019 Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen
Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen Partnergeweld tegen migrantenvrouwen
Partnergeweld tegen migrantenvrouwen MIT worstelt met het standpunt van vroege leiders over inheemse Amerikanen
MIT worstelt met het standpunt van vroege leiders over inheemse Amerikanen Waarom dove gevangenen al ruim voor COVID-19 in een staat van lockdown zaten
Waarom dove gevangenen al ruim voor COVID-19 in een staat van lockdown zaten Onderzoekers bouwen een transistor van een molecuul en een paar atomen
Onderzoekers bouwen een transistor van een molecuul en een paar atomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

