
Wetenschap
Onderzoekers hebben geheimen ontgrendeld over gemanipuleerde eiwitreceptoren, AUTO
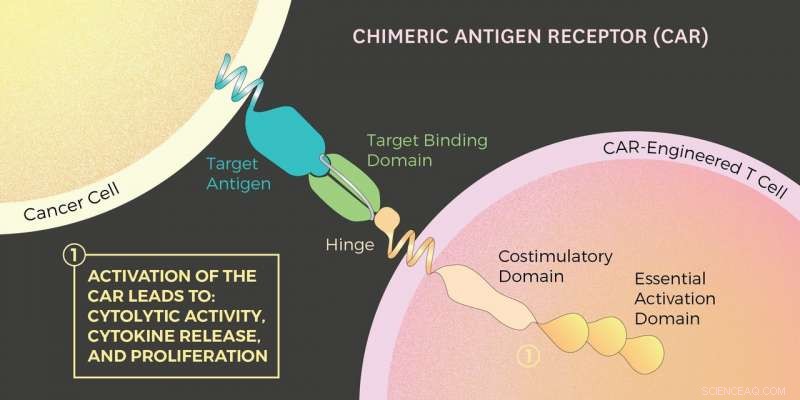
Illustratie van chimere antigeenreceptor (CAR). Krediet:Madelin Lum / USC Viterbi School of Engineering
Kanker blijft de tweede belangrijkste doodsoorzaak in de Verenigde Staten. Dit jaar, er zullen naar schatting 1,7 miljoen nieuwe gevallen worden gediagnosticeerd, met bijna 610, 000 mensen zullen naar verwachting sterven aan de ziekte, volgens het National Cancer Institute.
Gelukkig, verschillende recente kankerbehandelingen zijn veelbelovend. Onder hen is chimere antigeenreceptor (CAR) T-celtherapie, die de American Society of Clinical Oncology onlangs de "2018 Advance of the Year" noemde. Drie onderzoekers van de USC Viterbi School of Engineering - assistent-professor Stacey Finley, Professor Pin Wang en assistent-professor Nick Graham hebben zojuist een paper gepubliceerd in Biofysisch tijdschrift dat licht werpt op hoe deze nieuwe behandeling werkt, informatie die op een dag zou kunnen resulteren in betere kankertherapieën met minder bijwerkingen.
"We proberen in de moleculaire mechanismen te graven, " zei Bram, een assistent-professor chemische technologie en materiaalkunde. "Door te begrijpen hoe de CAR T-cellen werken, we zouden kunnen proberen betere te ontwerpen."
Wanneer het immuunsysteem normaal functioneert, immuuncellen bewegen door het lichaam en zoeken naar ziekteverwekkers die er niet thuishoren en doden ze. Echter, kankercellen kunnen zichzelf maskeren, waardoor het moeilijker wordt voor de goede cellen, zoals T-cellen, om ze te doden.
Met CAR T-celtherapie, de T-cellen van een persoon worden verwijderd, genetisch gemanipuleerd met eiwitten, en vervolgens terug in de patiënt geïnjecteerd. De resulterende CAR T-cellen zijn veel beter in het bestrijden van kankercellen. Dat komt omdat deze gemodificeerde CAR T-cellen een gemanipuleerde eiwitreceptor hebben, de auto, die zich aan kankercellen kunnen binden. Wanneer dit gebeurt, een signaal van de CAR vertelt de T-cel om de kanker te vernietigen door de chemicaliën perforine en granzyme af te scheiden.
CAR T-celtherapieën
Eerder dit jaar, de Amerikaanse Food and Drug Administration keurde de eerste CAR T-celtherapie goed voor de behandeling van sommige mensen met gevorderde leukemie en een vorm van lymfoom, beide bloedkankers. De eerste resultaten zijn veelbelovend gebleken. Echter, bij vroege testen, de CAR-T-celtherapieën zijn tot nu toe veel minder effectief gebleken tegen borst-, long, prostaatkanker en andere solide tumoren. Aanvullend, sommige mensen die CAR T-celtherapie ondergaan, hebben aanzienlijke bijwerkingen ondervonden; een paar zijn zelfs overleden.
Het drietal USC-onderzoekers hoopt dat hun werk de CAR T-celtherapieën aanzienlijk zal verbeteren door het gecompliceerde proces bloot te leggen waarmee CAR's kankerbestrijdende cellen activeren. specifiek, ze onderzoeken een proces dat fosforylering wordt genoemd, dat is een chemische reactie die optreedt wanneer de CAR-receptor tegen een kankercel botst en een signaal naar de T-cel stuurt om de slechte cellen aan te vallen.
"Ik denk dat het meest opwindende is dat we echt aan het veld een begrip toevoegen van welke locaties in de CAR gefosforyleerd worden, hoe snel dat gebeurt en de hoeveelheid fosforylering van elke site, " zei Finley, de Gordon S. Marshall Early Career Chair en universitair docent biomedische technologie, chemische technologie en materiaalkunde en biologische wetenschappen.
Door hun onderzoek, Finley, Wang en Graham hebben geleerd wanneer en hoeveel fosforylering plaatsvindt op de zes locaties van de CAR, die, in een onvolmaakte analogie, kunnen worden voorgesteld als "docking-hubs, ’ in de woorden van Graham.
Aanvullend, ze hebben ontdekt dat er geen "poortwachter" bestaat, wat betekent dat geen enkele CAR-site vóór de andere moet worden gefosforyleerd. Tot nu, geleerden hadden alleen een algemeen idee over het fosforyleringsproces, waardoor het moeilijk wordt om CAR T-cellen te ontwikkelen die met succes kunnen vechten tegen complexe en gecompliceerde borst, longkanker en andere kankers met vaste tumoren.
Betere kankerbestrijdende CAR's
Vooruit gaan, Finley, Wang en Graham hopen hun bevindingen te gebruiken om effectievere kankerbestrijdende CAR's te ontwikkelen met minder bijwerkingen. Dit zou kunnen betekenen dat fosforylering sneller en intenser plaatsvindt op bepaalde CAR-locaties, afhankelijk van de complexiteit van de beoogde kankercellen. Afwisselend, de USC-onderzoekers zouden CAR's kunnen ontwerpen om minder te fosforyleren, waardoor wordt voorkomen dat de kankerbestrijdende T- en andere cellen te agressief worden en gezonde cellen doden - een probleem dat opdook bij vroege CAR T-celkankerbehandelingen.
Nu al, Finley heeft kwantitatieve modellen gebouwd die veelbelovend zijn.
"Zodra we deze tools en kwantitatieve modellen hebben, we zouden ze moeten kunnen toepassen op een verscheidenheid aan verschillende ontwerpen van auto's, " zei Finley, wiens onderzoeksgroep expertise heeft in wiskundige modellen. "Misschien kun je een model gebruiken, voordat je een experiment doet, om te zien of dit nieuwe ontwerp zou werken. In plaats van zoveel vervelende experimenten in het lab te moeten doen, je zou een voorspellend wiskundig model kunnen bouwen om het beste ontwerp te screenen."
Wang toegevoegd, de Zohrab A. Kaprielian Fellow in Engineering en hoogleraar chemische technologie en materiaalkunde, en biomedische technologie:"Als je de T-cellen krachtiger wilt maken, de vraag is hoe je de CAR het beste kunt ontwerpen. Dat is het doel van ons onderzoek, I denk."
 Wereld staat voor zware klimaatstrijd nu de Amerikaanse inspanningen te kort schieten
Wereld staat voor zware klimaatstrijd nu de Amerikaanse inspanningen te kort schieten Honderden wetenschappers beginnen aan een missie om de voorspellingen van de luchtkwaliteit te verbeteren
Honderden wetenschappers beginnen aan een missie om de voorspellingen van de luchtkwaliteit te verbeteren Nieuwe lessen uit de ergste olieramp ooit
Nieuwe lessen uit de ergste olieramp ooit Voorbeelden van koolstofmoleculen die een rol hebben in het dagelijks leven
Voorbeelden van koolstofmoleculen die een rol hebben in het dagelijks leven Nieuwe studie onthult scheuren onder gigantische, methaan stromende kraters
Nieuwe studie onthult scheuren onder gigantische, methaan stromende kraters
Hoofdlijnen
- De ellende van Merkel neemt toe als minister van Landbouw orders negeert (update)
- Verbazingwekkende diversiteit aan soorten gerapporteerd over Solent oesterrestauratieproject
- Apparaat kan zeevogels redden van de gevaren van vistuig
- Specialiteiten van de rechterkant van de hersenen
- Epigenetica: definitie, hoe het werkt, voorbeelden
- Twee nieuwe soorten schaaldieren ontdekt op Galicische zeebodem
- Celdeling: hoe werkt het?
- Studie vindt paarden-DNA in 10 procent van vleesgerechten in Mexico
- Hoe MRNA naar TRNA
- Chemici ontdekken manier om nieuwe stikstofproducten uit het niets te maken

- Groene waterstof:roest als fotoanode en zijn grenzen

- Gouddeeltjes gebruiken om het onzichtbare zichtbaar te maken

- Wetenschappers ontwikkelen een innovatieve methode voor het vullen en afdichten van pleuraholtes

- Kleine biologisch afbreekbare circuits voor het vrijgeven van pijnstillers in het lichaam

 Inkt van oude Egyptische papyri bevat koper
Inkt van oude Egyptische papyri bevat koper Hoeveel water is nodig om zout op te lossen?
Hoeveel water is nodig om zout op te lossen?  Autobezit zal waarschijnlijk tot het verleden gaan behoren - en dat geldt ook voor het openbaar vervoer
Autobezit zal waarschijnlijk tot het verleden gaan behoren - en dat geldt ook voor het openbaar vervoer Onderzoekers creëren nieuwe microdeeltjes die zichzelf assembleren als atomen tot moleculen
Onderzoekers creëren nieuwe microdeeltjes die zichzelf assembleren als atomen tot moleculen Butterfly Skeletal System
Butterfly Skeletal System Christenen willen meer steun van kerken bij geloofs-/werkkwesties, studie toont
Christenen willen meer steun van kerken bij geloofs-/werkkwesties, studie toont Tyfoons en andere rampen dwingen Japan om zijn plannen voor de toekomst van stad versus platteland te heroverwegen
Tyfoons en andere rampen dwingen Japan om zijn plannen voor de toekomst van stad versus platteland te heroverwegen Wat vindt het publiek van verantwoord ondernemen?
Wat vindt het publiek van verantwoord ondernemen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

