Wetenschap
Hoe wetenschappers infectieveroorzakende biofilms bestrijden
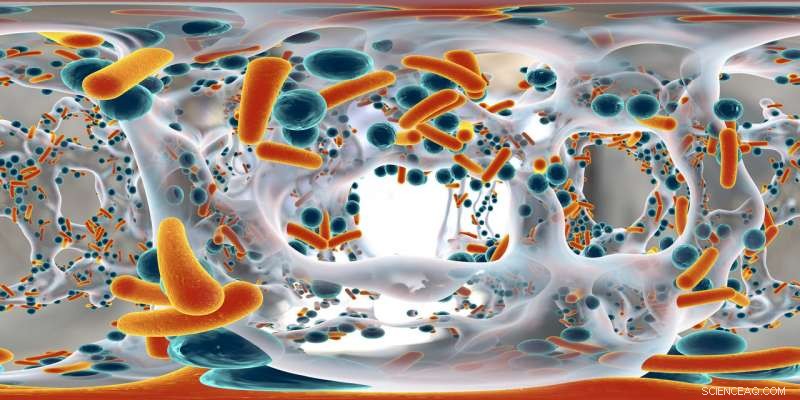
Een artistieke afbeelding van een biofilm die antibioticaresistente staafvormige en bolvormige bacteriën herbergt. Krediet:Kateryna Kon/Shutterstock.com
De oppervlakken waarmee mensen elke dag in aanraking komen, kunnen nogal alledaags lijken, maar op moleculaire schaal, er is meer activiteit dan op het eerste gezicht lijkt.
Elk oppervlak dat we aanraken heeft zijn eigen unieke chemische eigenschappen. Door deze eigenschappen blijven sommige materialen aan oppervlakken plakken, terwijl anderen afglijden. Voor een persoon, een plakkerig oppervlak kan een kleine ergernis zijn, maar voor een bacteriële cel, oppervlaktehechting kan een kwestie van leven en dood zijn. Bacteriën hebben hun eigen oppervlakken ontwikkeld om plakkerig te zijn, zoals klittenband.
Wanneer bacteriën een oppervlak koloniseren, ze creëren een gemeenschap die een biofilm wordt genoemd, die een bron van infectie kunnen zijn op medische hulpmiddelen of implantaten. De groeiende bezorgdheid over deze infecties heeft ertoe geleid dat een aantal onderzoekers materialen hebben ontwikkeld om deze soms gevaarlijke films te blokkeren.
Als biofysische chemici, mijn onderzoeksgroep en ik proberen de moleculaire krachten te begrijpen waardoor biologische moleculen - zoals die op bacteriën - zich tijdens de vroegste fasen van biofilmvorming aan oppervlakken kunnen hechten. Door deze vroege hechtingsfase te begrijpen, we kunnen de risico's verminderen dat zich een biofilm vormt op geïmplanteerde medische hulpmiddelen en een bedreiging vormt voor de mens.
Bacteriële kolonies
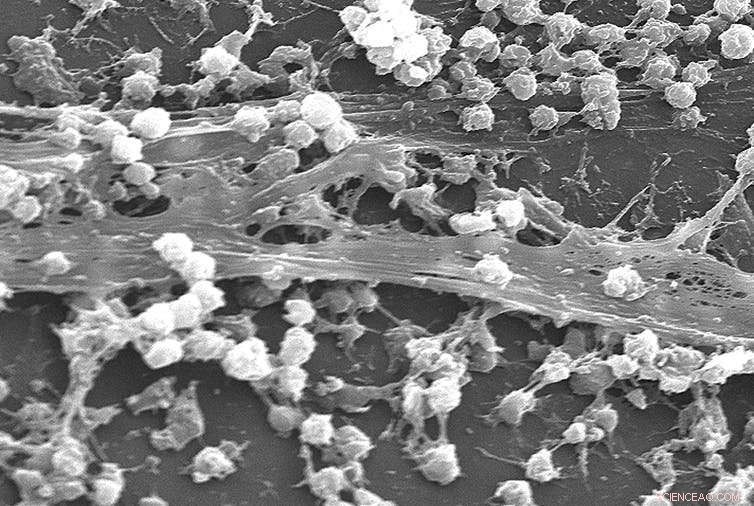
Staphylococcus aureus biofilm op het oppervlak van een katheter. Krediet:Rodney M. Donlan, Janice Carr /CDC
Biofilms zijn dicht opeengepakte gemeenschappen van bacteriën of andere micro-organismen die op een oppervlak leven. Als een stad, groeien binnen een biofilm heeft bepaalde voordelen. Bijvoorbeeld, het biedt structurele ondersteuning, als de vloeren van een flatgebouw, en microben kunnen voedingsstoffen delen. In vergelijking met vrij zwevende bacteriën, bacteriën in een biofilm worden afgeschermd, waardoor ze ons immuunsysteem kunnen ontwijken en antibiotica kunnen weerstaan.
Wanneer zich biofilms vormen op medische apparaten of implantaten, ze kunnen dienen als een aanhoudende bron van moeilijk te behandelen infecties. Deze kosten niet alleen miljarden dollars om te behandelen, maar claimen elk jaar duizenden levens in de VS alleen.
Wetenschappers proberen te begrijpen hoe biofilms ontstaan en hoe ze te voorkomen. Moleculair biologen onderzoeken hoe bacterieel DNA codeert voor de machinerie waarmee cellen zich aan oppervlakken en aan elkaar kunnen hechten. Microbiologen en medicinale chemici zijn op zoek naar medicijnen die biofilms kunnen binnendringen en verstoren. En biofysische chemici zoals ik proberen de moleculaire interacties te ontrafelen die deze biofilms moeilijk te voorkomen maken.
Oppervlakte complexiteit
Staphylococcus aureus en S. epidermidis zijn twee bacteriesoorten die normaal gesproken weinig problemen opleveren voor ons lichaam. Echter, wanneer zich een stafylokokkenbiofilm vormt op het oppervlak van een medisch implantaat zoals een kunstheup, deze cellen kunnen ziekte veroorzaken. Stafylokokkenbiofilms worden bij elkaar gehouden door suikers of polysachariden, eiwitten en nucleïnezuren, de moleculaire bouwstenen van alle levende organismen. Deze componenten zorgen ervoor dat de bacteriecellen niet alleen aan elkaar kleven, maar ook op natuurlijke en geïmplanteerde oppervlakken in het lichaam – zoals een hartklep.
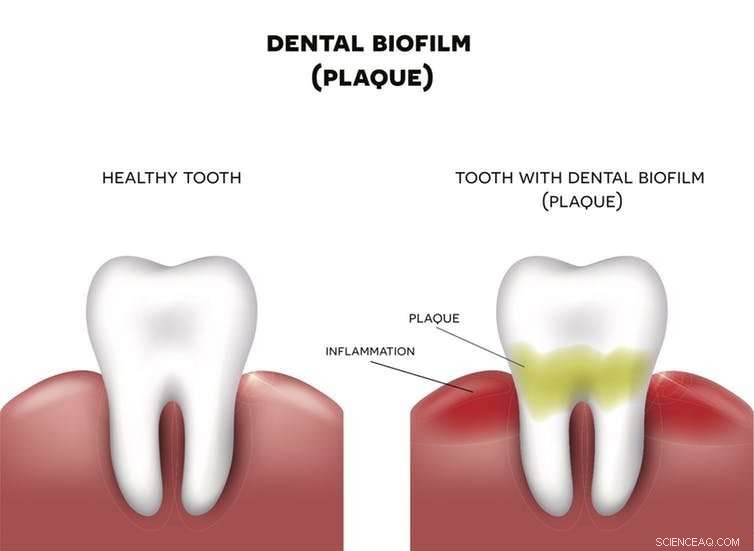
Biofilms doordringen alle elementen van ons leven. De tandplak die zich op je tanden vormt, is bijvoorbeeld een biofilm die bacteriën beschermt. Als de plaque niet wordt verwijderd, het weefsel rond de tand zal ontstoken raken. Krediet:Nita_Nita/Shutterstock.com
De oppervlakken van medische hulpmiddelen zijn complex, vooral als ze eenmaal aan het lichaam zijn blootgesteld. Menselijke bloedeiwitten bedekken snel het oppervlak van medische implantaten, het veranderen van het karakter naarmate zowel de patiënt als het apparaat ouder worden. Wanneer een bacteriecel zich hecht aan een van deze oppervlakken, de componenten van de cel interageren met het oppervlak van het medische implantaat, een complex netwerk van interacties vormen. In ons onderzoek, we onderzoeken de bacteriële oppervlakte-eiwitten die betrokken zijn bij oppervlaktehechting.
Het bestuderen van deze interacties is een uitdaging. Typisch, chemische experimenten worden uitgevoerd in oplossing, maar biofilm-experimenten moeten op een oppervlak worden gedaan. Het detecteren van de moleculen aan het oppervlak is een uitdaging. Dat komt omdat er minder van die moleculen zijn in vergelijking met het totale volume van het materiaal, net zoals de schil van de tomaat een kleine fractie is van de massa van de hele tomaat.
Introductie van de nanoschaal
Om deze beperking te overwinnen, we onderzoeken hoe eiwitten die aanwezig zijn op het bacteriële oppervlak interageren met nanodeeltjesoppervlakken. specifiek, we gebruiken nanodeeltjes die zijn ontworpen om het oppervlak van medische apparaten na te bootsen, en we richten ons op eiwitten die betrokken zijn bij stafylokokkeninfecties, een belangrijke bron van ziekenhuisgerelateerde ziekten.
Nanodeeltjes hebben een veel kleinere diameter dan een bacteriecel. Maar terwijl een typische cel een nanodeeltje zou verkleinen, het nanodeeltje is nog steeds veel groter dan de moleculen op het oppervlak van een cel. Door veel nanodeeltjes te gebruiken, is het gemakkelijker om te observeren hoe de bacterie en het deeltje op elkaar inwerken en om de bacteriële moleculen te observeren die betrokken zijn bij biofilmvorming.

Randika Perera plaatst een nanodeeltjesmonster in een NMR-spectrometer, een van de instrumenten die worden gebruikt om eiwit-oppervlakte-interacties te bestuderen. Krediet:Sarah Tewolde, MSU Office of Public Affairs, CC BY-SA
specifiek, we proberen de structuur en oriëntatie van eiwitten op verschillende soorten oppervlakken te begrijpen. Hoewel we niet de eerste of de enige groep zijn die geïnteresseerd is in dit onderwerp, ons werk is begonnen met het onthullen van de moleculaire details van hoe eiwitten interageren met nanodeeltjesoppervlakken.
We kunnen onderzoeken hoe stevig de bacteriën zich aan een oppervlak hechten - en we kunnen onderzoeken hoe eiwitmoleculen strijden om hetzelfde oppervlak. Bijvoorbeeld, gegeven een verzameling bacteriële eiwitten, welke van deze zal uiteindelijk hechten aan het oppervlak van een medisch implantaat?
Naarmate we de antwoorden op deze vragen ontdekken, kunnen we de belangrijke elementen identificeren die betrokken zijn bij vroege biofilmvorming. Dit zal nuttig zijn voor wetenschappers die die interacties therapeutisch proberen te remmen, of degenen die nieuwe biofilm-resistente oppervlakken willen ontwerpen.
Dit artikel is opnieuw gepubliceerd vanuit The Conversation onder een Creative Commons-licentie. Lees het originele artikel. 
 Polymeerprofessor ontwikkelt veiliger onderdeel voor lithiumbatterijen
Polymeerprofessor ontwikkelt veiliger onderdeel voor lithiumbatterijen De reisroute van protonen in polymeren kan de weg wijzen naar schone brandstoffen
De reisroute van protonen in polymeren kan de weg wijzen naar schone brandstoffen Hoe optische pincetten een van de grootste uitdagingen van misdaadlabs kunnen aanpakken
Hoe optische pincetten een van de grootste uitdagingen van misdaadlabs kunnen aanpakken Voorbeelden van niet-mengbare vloeistoffen
Voorbeelden van niet-mengbare vloeistoffen  Schoon, elektrisch aangedreven proces om commercieel belangrijke metalen in één stap te scheiden van sulfidemineralen
Schoon, elektrisch aangedreven proces om commercieel belangrijke metalen in één stap te scheiden van sulfidemineralen
Hoofdlijnen
- Structurele niveaus van organisatie van het menselijk lichaam
- Nieuwe methode voor het planten van citrusvruchten stopt insecten, levert extra voordelen op
- Welke drie omstandigheden zijn ideaal voor bacteriën om te groeien?
- Episch taaie baobabbomen sterven af in Afrika
- Natuurlijke selectie: definitie, Darwins-theorie, voorbeelden en feiten
- Parasieten en gastheren kunnen anders reageren op een warmere wereld
- Amerikaans sage hoenbeleid keert terug naar af
- Genmutatie: definitie, oorzaken, typen, voorbeelden
- Welke vier dingen maken ribosomen anders dan organellen?
 Democratie in verval voor een derde van de wereld
Democratie in verval voor een derde van de wereld Kunnen we energie van tornado's en orkanen benutten?
Kunnen we energie van tornado's en orkanen benutten?  Experimenten testen hoe gemakkelijk het leven zelf kan zijn
Experimenten testen hoe gemakkelijk het leven zelf kan zijn Nieuw onderzoek onthult politieke veranderingen veroorzaakt door de Zwarte Dood
Nieuw onderzoek onthult politieke veranderingen veroorzaakt door de Zwarte Dood Oud Fenicisch DNA uit Sardinië, Libanon weerspiegelt nederzetting, integratie, mobiliteit
Oud Fenicisch DNA uit Sardinië, Libanon weerspiegelt nederzetting, integratie, mobiliteit Onderzoekers meten afzonderlijke atomen in een grafeen-petrischaal
Onderzoekers meten afzonderlijke atomen in een grafeen-petrischaal ONS, China leidt race voor 5G draadloos:enquête
ONS, China leidt race voor 5G draadloos:enquête Onderzoek:lood in wat Canadees water erger dan vuursteen
Onderzoek:lood in wat Canadees water erger dan vuursteen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com