
Wetenschap
Computer herontwerpt enzym

RUG-wetenschappers Dr. Hein Wijma (links) en Prof. Dr. Dick B. Janssen, die een nieuwe computationele benadering gebruikte om het aspartase-enzym opnieuw te ontwerpen en om te zetten in een katalysator voor asymmetrische hydroamineringsreacties. Credit:Rijksuniversiteit Groningen
Biotechnologen van de Rijksuniversiteit Groningen gebruikten een computationele methode om aspartase opnieuw te ontwerpen en om te zetten in een katalysator voor asymmetrische hydroamineringsreacties. Hun collega's in China hebben de productie van dit enzym opgeschaald en zijn erin geslaagd om kilo's zeer zuivere bouwstenen voor geneesmiddelen en andere bioactieve stoffen te produceren. Deze succesvolle proof-of-principle-studie is gepubliceerd in Natuur Chemische Biologie op 21 mei.
Enzymen zijn natuurlijke katalysatoren die onder milde omstandigheden werken. Ze zijn een aantrekkelijk alternatief voor niet-gekatalyseerde chemische reacties die vaak energieverslindende hoge temperaturen of druk vereisen en die giftige bijproducten kunnen genereren of oplosmiddelen kunnen gebruiken. Maar er is één probleem:de reeks reacties die door enzymen worden gekatalyseerd, is beperkt. "Daarom wordt er veel energie gestoken in het modificeren van natuurlijke enzymen, " legt Dick Janssen uit, Hoogleraar Chemische Biotechnologie aan het Groningen Biomolecular and Biotechnology Institute.
De klassieke methode om enzymen te modificeren is gerichte evolutie, een mutatie-selectiesequentie in het laboratorium die tot doel heeft enzymen te maken met gemodificeerde katalytische vermogens. Maar het kost veel werk om honderden of duizenden enzymvarianten in meerdere rondes te maken en te testen. Het zou veel efficiënter zijn om een rationeel ontwerp te maken van de benodigde veranderingen op basis van informatie over de structuur en eigenschappen van het enzym.
Maar zelfs dit is ingewikkeld, legt Hein Wijma uit. Hij is een expert in moleculaire ontwerpsoftware en deed het meeste rekenwerk in het onderzoek. "Eiwitten zijn gemaakt van 20 verschillende aminozuren. Dus als je een enzym op vier posities wilt veranderen, er zijn 20 opties voor elk van hen. Dat resulteert in een enorme matrix van eiwitstructuren." Door ze één voor één te testen, zelfs op de computer duurt te lang. Echter, een zeer snel Monte Carlo-zoekalgoritme versnelt de ontdekking van de juiste uitkomst door te zoeken naar trends in de reactiviteit van het enzym.
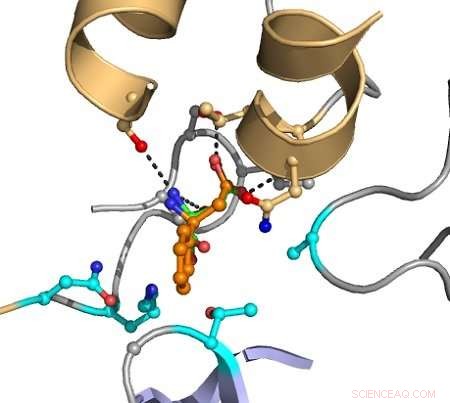
De onderbroken lijnen geven interacties tussen atomen aan die katalyse veroorzaken. Het doelsubstraat wordt oranje weergegeven, en de in magenta aangegeven groepen worden in de computer gevarieerd om mutanten te ontdekken die de conversie verbeteren. Credit:Hein Wijma/Universiteit Groningen
"Uiteindelijk, het duurde een paar dagen om deze zoekopdracht uit te voeren in een speciaal computercluster aan de Rijksuniversiteit Groningen, ", zegt Wijma. Maar vooraf was er veel modellering nodig. "Je moet het reactieve centrum modelleren, de zakken waar het substraat bindt, en de afstand tussen de aminozuren en hun relatieve posities en hoeken bepalen." Aangezien de groep één enzym (aspartase) als uitgangspunt gebruikte voor een aantal verschillende reacties, het uitgangspunt was altijd hetzelfde. Dit betekende dat ze alleen de doelreactie hoefden te veranderen. Wijma:"Als we een nieuwe modificatie van aspartase wilden maken, dat zou nu waarschijnlijk nog maar drie maanden duren."
Het onderzoekspaper beschrijft vier conversies, alle toevoegingen van ammonium. Aspartase is een deaminase, dus de reactie was omgekeerd. "Katalyse gaat twee kanten op, dus dat is geen groot probleem " zegt Janssen. Voor elke conversie, de eerste selectie door het algoritme leverde zo'n 100 veelbelovende mutanten op. Deze werden vervolgens gecontroleerd op duidelijke fouten. Janssen:"Uiteindelijk zo'n vijf tot twintig mutanten werden daadwerkelijk in het laboratorium gemaakt en getest om te zien of ze functioneerden zoals verwacht."
De volgende stap was het testen van succesvolle mutante enzymen in een opgeschaalde setting. "Dit werk is gedaan door een voormalig promovendus en postdoc van ons lab, Bian Wu, die nu assistent-professor is in China, ", vertelt Janssen. "Hij liet zien welke kandidaten grote hoeveelheden van het benodigde product kunnen produceren." Substraatconversies van 99 procent met een enantioselectiviteit van 99 procent werden bereikt in hoeveelheden tot een kilogram, wat betekent dat de enzymen die door de berekeningsmethoden worden voorspeld, geschikt lijken voor gebruik in een industriële omgeving. "Dit is echt een bewijs van het principe dat onze methode van in-silico selectie van mutanten werkt voor het produceren van bruikbare enzymen, ’ besluit Janssen.
Hoofdlijnen
- Verschillen tussen een neuron en een neuroglia
- Horzels lokken:wetenschappers ontsluiten seksferomoon van berucht honingbij-roofdier
- De microbiologische kunst van het maken van een betere worst
- 5 manieren waarop je hersenen je emoties beïnvloeden
- De twee soorten exocriene secretoire cellen in de maag
- Eenvoudige manieren om de structuren van de Skull
- Linnaean-classificatie: definitie, niveaus en voorbeelden (met grafiek)
- Chronische verspillende ziekte:de problemen met de prionziekte van hertachtigen aanpakken
- Tips voor bedwantsen voor vakantiereizigers
- Hoe de dikke darm prioriteit geeft aan gasontgifting boven energieverbruik?
- Wetenschappers ontwikkelen nieuwe transparante breedband afschermende materialen voor elektromagnetische interferentie

- Ontdekking kan nucleair afval verminderen met een verbeterde methode om moleculen chemisch te ontwikkelen

- Wat is een polaire molecule?

- Eiwit afgeleid van haver is in nieuwe techniek gekoppeld aan celzelfmoord-enzym

 De impact van technologische materialen voor de koolstofarme transitie beperken
De impact van technologische materialen voor de koolstofarme transitie beperken Beroemde Deltalandforms
Beroemde Deltalandforms Objecten verplaatsen op nanoschaal met behulp van thermische gebieden
Objecten verplaatsen op nanoschaal met behulp van thermische gebieden Onderzoekers ontdekken moleculaire mechanismen van een Afrikaans volksgeneesmiddel
Onderzoekers ontdekken moleculaire mechanismen van een Afrikaans volksgeneesmiddel Transistors manipuleren op terahertz-frequenties
Transistors manipuleren op terahertz-frequenties Wat gebeurt er met je cellen als je uitgedroogd bent?
Wat gebeurt er met je cellen als je uitgedroogd bent?  Fotonische hyperkristallen werpen sterker licht
Fotonische hyperkristallen werpen sterker licht Hubble Space Telescope buitenspel gezet door ernstige aanwijsfout (update)
Hubble Space Telescope buitenspel gezet door ernstige aanwijsfout (update)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


