
Wetenschap
Wetenschappers onthullen verschillende substraatbindingsmodus in o-succinylbenzoyl-CoA-synthetase
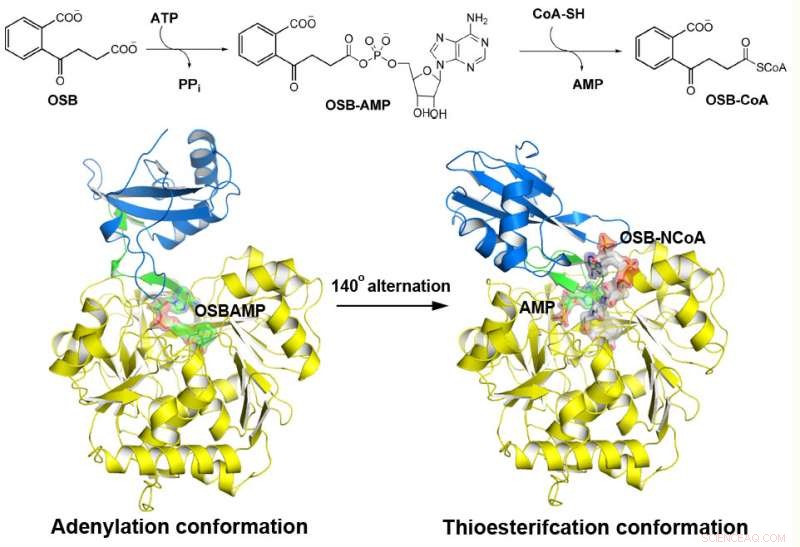
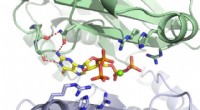
MenE katalyseert een reactie in twee stappen in twee verschillende structuren. Krediet:Afdeling Chemie, HKUST
o-Succinylbenzoyl-CoA (OSB-CoA) synthetase (MenE) is een essentieel enzym in de bacteriële vitamine K-biosynthese en een belangrijk doelwit bij de ontwikkeling van nieuwe antibiotica. Het is een lid van de familie van adenylerende enzymen (ANL), die hun actieve site herconfigureren in twee verschillende actieve conformaties, één voor de adenyleringshalfreactie en de andere voor een thioesterificatiehalfreactie, in een katalytisch mechanisme voor domeinafwisseling. Hoewel recentelijk verschillende aspecten van het adenyleringsmechanisme in MenE zijn ontdekt, de thioesterificatie conformatie blijft ongrijpbaar.
Met behulp van een katalytisch competent Bacillus subtilis-mutant eiwit gecomplexeerd met een OSB-CoA-analoog, onderzoekers van de Hong Kong University of Science and Technology onthulden een actieve site voor thioesterificatie die specifiek geconserveerd is tussen MenE-orthologen en een substraatbindingsmodus die verschilt van die van veel andere acyl / aryl-CoA-synthetasen. Er werden verschillende residuen geïdentificeerd die specifiek bijdragen aan de thioesterificatie-halfreactie zonder de adenyleringshalfreactie te beïnvloeden, en ze observeerden ook een aanzienlijke beweging van de geactiveerde succinylgroep in de halfreactie van de thioesterificatie.
Hun bevindingen werden gepubliceerd in de Tijdschrift voor biologische chemie op 21 juli, 2017.
"Onze bevindingen bieden nieuwe inzichten in de katalyse van domeinafwisseling van een bacterieel enzym dat essentieel is voor vitamine K-biosynthese, en van zijn adenylerende homologen in de ANL-enzymfamilie, " zei Zhihong Guo, een universitair hoofddocent bij de afdeling Chemie van HKUST. "Ons werk bevestigde de hypothese dat een specifieke substraatbindingsmodus uniek is voor dit enzym."
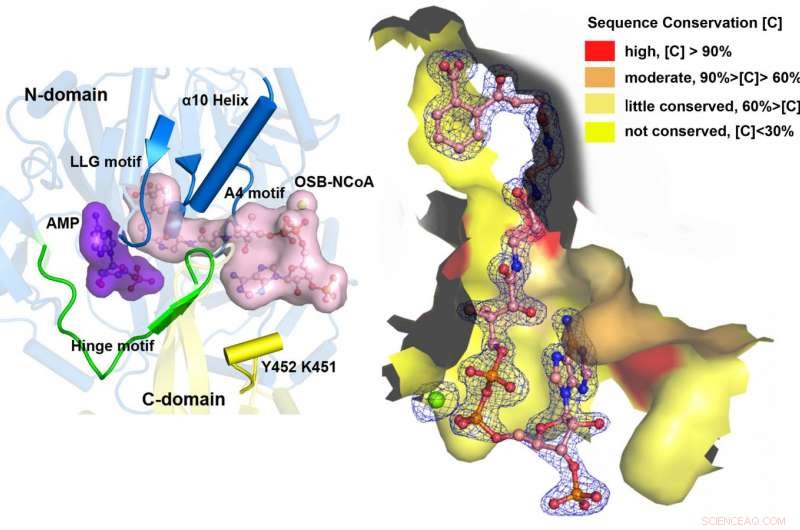
MenE katalyseert een reactie in twee stappen in twee verschillende structuren. Krediet:Afdeling Chemie, HKUST
Als lid van de ANL-enzymfamilie, OSB-CoA-synthetase (MenE) is een waardevol doelwit voor geneesmiddelen in de biosyntheseroute van vitamine K, maar er is nog weinig bekend over de structuur van het enzym.
"We hebben kristalstructuren met hoge resolutie geconstrueerd van een katalytisch competente dubbele mutant (IRAK) van bsMenE in complex met een stabiel productanaloog, OSB-NCoA, en een combinatie van OSB-NCoA en AMP, "zei Guo. "Bovendien, deze kristalstructuren onthulden de aminozuurresiduen die bijdragen aan de herkenning en binding van de substraten en producten in de thioesterificatiereactie. Deze resultaten hebben niet alleen ondubbelzinnige ondersteuning geboden voor het katalytische mechanisme van domeinafwisseling van ANL-enzymen in het algemeen; ze hebben ook de unieke thioesterificatie-actieve plaats van OSB-CoA-synthetasen onthuld en de structurele basis geleverd voor hun katalyse van de thio-esterificatiereactie om hun bruikbaarheid als medicijndoelwit te vergemakkelijken."
"Onze bevindingen bieden nieuwe inzichten in het domeinafwisselingsmechanisme van het essentiële vitamine K-biosynthetische enzym en zijn homologen in de ANL-enzymfamilie, en ons zal helpen om op een continue manier een eiwitkatalytische cyclus op te bouwen, wat niemand eerder heeft gedaan."
 Sandia begint aan Arctisch zeebodemgegevensproject met behulp van nieuwe onderwatertechniek
Sandia begint aan Arctisch zeebodemgegevensproject met behulp van nieuwe onderwatertechniek Belang van een MER in milieubescherming
Belang van een MER in milieubescherming De stratosfeer:waar vogels en vliegtuigen vliegen en bacteriën gedijen
De stratosfeer:waar vogels en vliegtuigen vliegen en bacteriën gedijen  Nieuwe lavastroom bedreigt nog meer gebouwen op La Palma
Nieuwe lavastroom bedreigt nog meer gebouwen op La Palma Hoe kan recycling helpen vervuiling te voorkomen?
Hoe kan recycling helpen vervuiling te voorkomen?
Hoofdlijnen
- Herstel van zeezoogdieren aan de westkust verhoogt de consumptie van chinookzalm
- Hoe beïnvloedt CO2 de opening van de huidmondjes?
- Fenotype: definitie, types, voorbeelden
- Worden je hersenen moe zoals de rest van je lichaam?
- Hoe genoctrooien werken
- Wat is de rol van ademhalingssystemen in homeostase?
- Native Plants & Animals of France
- Kerkuilen blijken geen gehoorverlies te hebben naarmate ze ouder worden
- Regenwormen kunnen zich voortplanten in Mars-bodemsimulant
- Nobelprijswinnende techniek zoals Google Earth voor moleculen

- Antivries van de natuur inspireert revolutionaire cryopreservatietechniek voor bacteriën
- Nieuw waargenomen eenwaardige calciumionen vertonen onverwachte metaalachtigheid en ferromagnetisme
- Verbindingen in monsterradijs kunnen hart- en vaatziekten helpen temmen
- Methode om te onderzoeken hoe bacteriën reageren op honger, groei van sondecellen
 Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders
Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders De kern en de mantel van de aarde zijn op een wanordelijke manier gescheiden
De kern en de mantel van de aarde zijn op een wanordelijke manier gescheiden Aan koude aangepaste enzymen kunnen bij kamertemperatuur transformeren
Aan koude aangepaste enzymen kunnen bij kamertemperatuur transformeren Direct schrijven van diamantpatronen uit grafiet een potentiële technologische sprong
Direct schrijven van diamantpatronen uit grafiet een potentiële technologische sprong Gedeelde levensduur van grootmoeders en kleinkinderen aanzienlijk toegenomen sinds 1800
Gedeelde levensduur van grootmoeders en kleinkinderen aanzienlijk toegenomen sinds 1800 Planeetjagers ontdekken nieuwe in een miljoen superaarde
Planeetjagers ontdekken nieuwe in een miljoen superaarde Rode en zwarte gestreepte slangen identificeren
Rode en zwarte gestreepte slangen identificeren  Valency
Valency
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

