
Wetenschap
Methode om te onderzoeken hoe bacteriën reageren op honger, groei van sondecellen
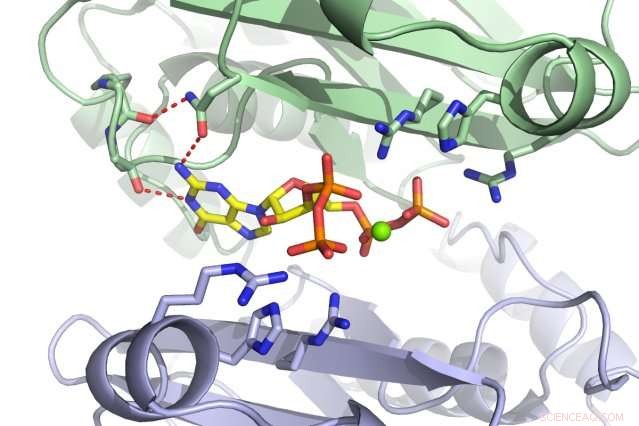
Een MIT-team heeft ontdekt dat het kleine molecuul ppGpp (rood) bindt aan het PurF-enzym (subeenheden weergegeven in groen en paars). Krediet:Massachusetts Institute of Technology
1969, wetenschapper Michael Cashel analyseerde de verbindingen geproduceerd door uitgehongerde bacteriën toen hij twee vlekken op zijn chromatogram zag verschijnen als bij toverslag. Vandaag, we kennen een van deze "magische plekken, " zoals onderzoekers ze noemen, als guanosinetetrafosfaat, of kortweg ppGpp. We begrijpen ook dat het een signaalmolecuul is dat in vrijwel alle bacteriën aanwezig is, helpen de celgroei en -grootte af te stemmen op basis van de beschikbaarheid van voedingsstoffen.
En toch, ondanks decennia van studie, hoe ppGpp de groei van bacteriën precies reguleert, is nogal mysterieus gebleven. Verder graven vereist een uitgebreidere lijst van de moleculen die ppGpp bindt om zijn effecten uit te oefenen.
Nutsvoorzieningen, medewerkers van de afdelingen Biologie en Scheikunde van het MIT hebben een methode ontwikkeld om precies dat te doen, en gebruikten hun nieuwe aanpak om meer dan 50 ppGpp-doelen in Escherichia coli te lokaliseren - ongeveer de helft die nog niet eerder was geïdentificeerd. Veel van deze doelwitten zijn enzymen die nodig zijn om nucleotiden te produceren, de bouwstenen van DNA en RNA. In tijden dat de bacteriën niet genoeg voedingsstoffen hebben om normaal te groeien en te delen, de onderzoekers stellen voor dat ppGpp voorkomt dat deze enzymen vanaf het begin nieuwe nucleotiden creëren, cellen helpen in een slapende toestand te komen.
"Met kleine moleculen of metabolieten zoals ppGpp, het was historisch moeilijk om te bepalen welke eiwitten ze binden, " zegt Michael Laub, een professor in de biologie, een onderzoeker van het Howard Hughes Medical Institute, en de senior auteur van de studie. "Dit is een hardnekkig probleem dat het veld al een tijdje tegenhoudt, maar onze nieuwe aanpak stelt je in staat om de waarschijnlijke doelen in een kwestie van weken vast te stellen."
Postdoc Boyuan Wang is de eerste auteur van de studie, die verschijnt in Natuur Chemische Biologie op 17 december.
De magische plek
Sinds ppGpp bijna 50 jaar geleden werd ontdekt, het is aangetoond dat het DNA-replicatie onderdrukt, transcriptie, vertaling, en verschillende metabole routes. Het remt de celgroei en zorgt ervoor dat bacteriën kunnen volharden in het geval van honger, spanning, en antibiotica. De invloed ervan op tal van regelgevingsprocessen is enigszins een mysterie gebleven, echter - tenslotte, het moduleert niet alleen een enkel pad, maar coördineert tegelijkertijd meerdere operaties om een massale uitschakeling van de cel te orkestreren.
Om te onderscheiden welke eiwitten ppGpp bindt om een dergelijke wijdverbreide verandering te bewerkstelligen, de onderzoekers bouwden wat ze 'capture compounds' noemen die ppGpp bevatten, waardoor ze hun doelwitten uit bacteriële extracten kunnen vissen. Deze verbindingen omvatten een fotoreactieve crosslinker die stevig vastzat aan de eiwitten van belang in de aanwezigheid van licht, en een biotinehandvat dat de wetenschappers hielp de eiwitten eruit te halen om ze te identificeren. Het belangrijkste is, ze waren op zo'n manier met ppGpp verbonden dat ze niet zouden interfereren met zijn vermogen om zich aan zijn doelen te binden. Deze methode is efficiënter en nauwkeuriger in vergelijking met meer traditionele manieren om ppGpp-doelen te onderscheiden, die veel moeilijker zijn en niet gevoelig zijn.
"Onze aanpak lost deze problemen op omdat je niet langer zulke arbeidsintensieve protocollen hoeft te doen om ppGpp-doelen te identificeren - en het werkt zelfs bij bacteriën buiten E. coli, ", zegt Wang. "Hoewel ppGpp veel voorkomt bij veel bacteriesoorten, het lijkt zijn effecten uit te oefenen via verschillende mechanismen, wat de zaken compliceert. Onze capture-compounds bieden een manier om deze diversiteit te ontrafelen, en op korte termijn."
De productie van nucleotiden afremmen
Hoewel de 56 ppGpp-doelen die Wang in zijn scherm identificeerde een groot aantal cellulaire processen aansturen, hij ging in op het enzym PurF - dat de biosynthese initieert van purine-nucleotiden die adenine- en guaninebasen dragen, ook wel A en G genoemd.
Wanneer bacteriën gestrest of uitgehongerd zijn, ze gaan een slapende toestand in om te overleven. Maar alleen vertaling en transcriptie aan banden leggen is niet genoeg; nucleotiden worden nog steeds gegenereerd en zullen zich opbouwen als hun synthese niet op pauze wordt gezet. Cellen kunnen op twee manieren nucleotiden bouwen:ofwel door bestaande materialen te redden of door helemaal opnieuw te beginnen. PurF start de eerste stap in het laatste proces dat leidt tot de A- en G-nucleotiden. Echter, wanneer ppGpp bindt aan PurF, het zorgt ervoor dat het enzym van vorm verandert, waardoor het zijn werk niet kan doen, waardoor de productie van nucleotiden in de cel wordt verminderd.
"Dit is de eerste keer dat een enzym dat betrokken is bij die specifieke route of functie is geïdentificeerd als een ppGpp-doelwit, Wang zegt. "Als je de consumptie van nucleotiden beperkt, maar niet hun productie, de nucleotidepool gaat exploderen, wat niet goed is voor de cel. We hebben dus aangetoond dat ppGpp dit probleem ook daadwerkelijk aanpakt."
Naast PurF en andere enzymen die nodig zijn voor de productie van nucleotiden, de onderzoekers merkten op dat ppGpp zich ook bindt aan veel GTPase-enzymen die bij translatie betrokken zijn. Dit kan duiden op een faalveilig mechanisme dat de vertaling vertraagt door meerdere, soortgelijke enzymen op een bijna overbodige manier in het licht van de hongersnood.
Terwijl Wang zijn methode blijft verfijnen, hij wil de specificiteit ervan vergroten en ervoor zorgen dat zijn capture-verbindingen zich aan exact dezelfde eiwitten binden als in een levende cel. Hij hoopt ook te screenen op ppGpp-bindende eiwitten in andere bacteriën, inclusief pathogenen die afhankelijk zijn van ppGpp om te overleven in hun gastheren en om aandoeningen zoals tuberculose te verspreiden.
"Dit is een opwindende chemische benadering om de functie van een lang bestudeerd geconserveerd signaalmolecuul in bacteriën beter te begrijpen, " zegt Jue Wang, hoogleraar bacteriologie aan de Universiteit van Wisconsin in Madison, die niet bij het onderzoek betrokken was. "Hun bevindingen en technieken zijn zeer relevant voor veel andere bacteriën, en zal de kennis aanzienlijk verbeteren over hoe bacteriën dit cruciale signaalmolecuul gebruiken om alles te bemiddelen, van overleven in de menselijke darm tot het veroorzaken van ziekten."
Laub voegt eraan toe:"Zelfs vandaag ontdekken we nog steeds nieuwe op nucleotiden gebaseerde signaalmoleculen in bacteriën, en elk van hen zou uiteindelijk op een vergelijkbare manier kunnen worden afgeleid om hun bindende partners te identificeren."
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Machine learning-innovatie om chemische bibliotheek voor medicijnontdekking te ontwikkelen
Machine learning-innovatie om chemische bibliotheek voor medicijnontdekking te ontwikkelen MRI-tags plakken aan moleculen met chemisch klittenband
MRI-tags plakken aan moleculen met chemisch klittenband Onderzoekers maken plastic film die het coronavirus onderdrukt
Onderzoekers maken plastic film die het coronavirus onderdrukt Een gemeenschappelijke elektronische taal voor magnetische resonantie
Een gemeenschappelijke elektronische taal voor magnetische resonantie Hoe werkt IR-spectroscopie?
Hoe werkt IR-spectroscopie?
Hoofdlijnen
- Kan slapen me gelukkig maken?
- Trucs voor het onthouden van dierenfylum
- Welke moleculen leveren energie voor spiercontracties?
- De Stoned Ape-hypothese:hebben paddo's de menselijke evolutie beïnvloed?
- Veldonderzoek heeft tot doel de verspreiding van door teken overgedragen ziekten in het Midwesten te vertragen
- Techniek op de plaats delict die wordt gebruikt om schildpadden te volgen
- Zijn er verschillen tussen mannelijke en vrouwelijke pesters?
- Moderne genomica gebruiken om krokodillenschubben in vogelachtige veren te veranderen
- Wat is de regeling in de microbiologie?
- Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd
- Hoe een bepaalde bacterie communiceert en ons ziek maakt
- Spray verven van vezelverbanden op wonden
- Het identificeren van designer medicijnen die worden ingenomen door patiënten met een overdosis

- Mijnafval kan worden gebruikt als ingrediënt voor goedkopere productie van waterstofbrandstof

 Hoe de brekingsindex van een formulering te berekenen
Hoe de brekingsindex van een formulering te berekenen Onderzoekers ontvouwen geheime stabiliteit van buigzame rietjes
Onderzoekers ontvouwen geheime stabiliteit van buigzame rietjes Precisie ongediertebestrijding:smartphone-app is het nieuwste wapen van boeren in gewasbescherming
Precisie ongediertebestrijding:smartphone-app is het nieuwste wapen van boeren in gewasbescherming Bosnische hoofdstad Sarajevo getroffen door gevaarlijke luchtvervuiling
Bosnische hoofdstad Sarajevo getroffen door gevaarlijke luchtvervuiling Onderzoekers wonen in op het tijdperk van de Yangtze-rivier
Onderzoekers wonen in op het tijdperk van de Yangtze-rivier Eerste kunstwerken op zakformaat uit Ice Age Indonesia tonen de eeuwenoude drang van de mensheid om te versieren
Eerste kunstwerken op zakformaat uit Ice Age Indonesia tonen de eeuwenoude drang van de mensheid om te versieren Legenden van de verloren reservoirs
Legenden van de verloren reservoirs Hoe krijg je 1,000 Stickers als eerste in Math
Hoe krijg je 1,000 Stickers als eerste in Math
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

