Wetenschap
Moleculaire volumeregeling
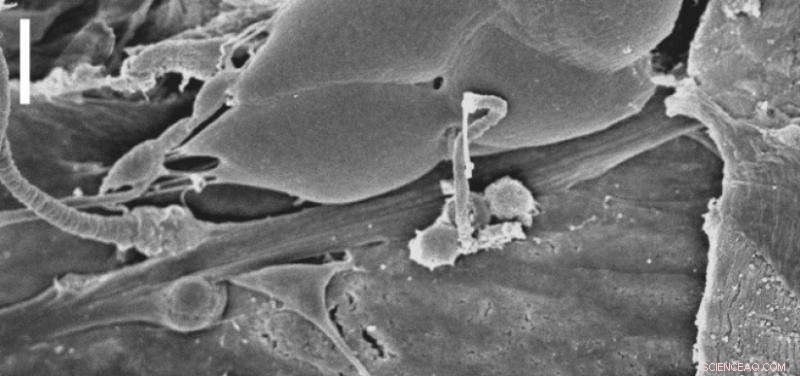
Het larvale Drosophila chordotonale orgaan gezien onder de scanning elektronenmicroscoop. Deze sensorische functionele eenheid moduleert de verwerking van mechanische stimuli door middel van de latrofilinereceptor. Schaal:10 µm. Krediet:Scholz et al., 2017
Ongeveer twee jaar geleden, wetenschappers van de Universiteit van Würzburg ontdekten dat een bepaalde klasse van receptoren in staat is mechanische prikkels waar te nemen. Nu zijn ze begonnen met het ontrafelen van de moleculaire mechanismen achter de ontdekking.
De receptor die de afgelopen jaren door wetenschappers van de universiteiten van Würzburg en Leipzig is onderzocht, werkt op dezelfde manier als de volumeregeling van een stereo-installatie die het binnenkomende signaal versterkt of verzwakt. De receptor in kwestie heet latrofiline/CIRL.
Iets meer dan twee jaar geleden, hadden de onderzoekers de wetenschappelijke gemeenschap verrast door te bewijzen dat bepaalde receptoren, inclusief latrofiline, reageren op mechanische prikkels uit de omgeving, bijvoorbeeld trillingen, geluidsgolven of expansie. Door het zo te doen, de receptoren helpen organismen om te horen, bewegingen waarnemen en hun eigen bewegingen beheersen.
Hoe de informatie in de cel komt
Destijds, echter, de details van de bijdrage van de receptoren waren nog onduidelijk, d.w.z. hoe het proces werkt op moleculair niveau. Ondertussen, de onderzoekers hebben enkele cruciale details kunnen belichten. Ze presenteren hun resultaten in het huidige nummer van het wetenschappelijke tijdschrift eLife. De hoofdauteurs van de studie zijn dr. Robert Kittel, die een werkgroep leidt aan het Instituut voor Fysiologie/Departement Neurofysiologie van de Universiteit van Würzburg, en professor Tobias Langenhan, die onlangs van Würzburg naar de Universiteit van Leipzig verhuisde.
"Om ervoor te zorgen dat cellen externe stimuli kunnen waarnemen en erop kunnen reageren, de informatie moet op de een of andere manier in de cel komen, " Robert Kittel legt het centrale aspect van het onderzoek uit. Dit kan worden bereikt via ionenkanalen waar een mechanische stimulus in een zeer eenvoudig en snel proces wordt omgezet in een elektrische respons.
Met de latrofiline-receptor ligt het anders:"Het vormt geen kanaal en het stuurt de stimulus niet elektrisch door, " zegt Kittel. In plaats daarvan, het activeert intracellulaire boodschappers die speciale signaalcascades in de cel veroorzaken die uiteindelijk ook de ionenkanalen beïnvloeden. Volgens Kittel, de receptor heeft dus een modulerend effect op de stimulusperceptie als een soort volumeregelaar.
Samenwerking met tal van experts
De zojuist gepubliceerde studie is het resultaat van samenwerking met specialisten uit verschillende domeinen van de Universiteit van Würzburg – een aspect dat Robert Kittel bijzonder op prijs stelt.
Een van de bijdragende experts is de plantenfysioloog Professor Georg Nagel, die een van de wetenschappers was die een beroemde techniek ontdekte die bekend werd als "optogenetica". Het onderliggende principe:Nagel karakteriseert ionenkanalen en enzymen die met licht kunnen worden aangestuurd. Robert Kittel en Tobias Langenhan gebruikten de larven van Drosophila, de fruitvlieg, voor hun experimenten die bijna transparant zijn, zodat de onderzoekers met eenvoudige lichtflitsen de werking van de receptoren konden bestuderen.
De tweede betrokken deskundige was professor Markus Sauer, hoofd van de afdeling Biotechnologie en Biofysica aan het Biocenter van de Universiteit van Würzburg. Met zijn team, Sauer ontwikkelde speciale vormen van hoge resolutie fluorescentiemicroscopie. Deze "superresolutie"-microscopie maakt het mogelijk om cellulaire structuren en moleculen in beeld te brengen met een tot tien keer hogere resolutie in vergelijking met conventionele optische microscopen. "Door superresolutiemicroscopie te gebruiken, we waren in staat om de positie van het celmembraan te bepalen waar de receptor zich bevindt, ' zegt Robert Kittel.
Dr. Isabella Maiellaro en professor Esther Asan zijn ook specialisten op het gebied van beeldvormende procedures. Door samen te werken met Isabella Maiellaro van de afdeling Farmacologie, de onderzoekers konden het intracellulaire receptorsignaal direct visualiseren. Esther Asan, Professor aan het Instituut voor Anatomie en Celbiologie II aan de Universiteit van Würzburg, droeg ook bij aan het succes van de studie met haar expertise in elektronenmicroscopie.
Bovendien, het project werd ondersteund door de uitgebreide ervaring van professor Matthias Pawlak aan het Instituut voor Fysiologie van de Universiteit van Würzburg op het gebied van sensorische fysiologie en Dr. Simone Prömel, een farmacoloog aan de Universiteit van Leipzig. Robert Kittel ziet deze samenwerkingen als een goed voorbeeld van hoe moderne biotechnologische methoden kunnen helpen bij het beantwoorden van fysiologische vragen.
Een zeer belangrijke moleculaire familie
Latrophilin/CIRL is een lid van een familie van moleculen die meer dan 30 leden heeft bij de mens:de zogenaamde adhesie-GPCR's, een subgroep van de G-eiwit-gekoppelde receptoren (GPCR's). Honderden van hen zijn gecodeerd in het menselijk genoom; hun belang wordt onder meer ondersteund door het feit dat ongeveer de helft van alle geneesmiddelen op recept zich op deze receptoren richten en helpen bij de behandeling van veelvoorkomende ziekten zoals hoge bloeddruk, astma of Parkinson.
Hieruit blijkt hoe belangrijk de onderzoeksresultaten van de wetenschappers uit Würzburg en Leipzig zijn. Ten slotte, weten wat er in de cellen gebeurt, is een voorwaarde voor het ontwikkelen van een beter begrip van pathologische processen en het ontwerpen van nieuwe therapieën. "De celbiologische processen zijn goed geconserveerd in termen van evolutie, " zegt Robert Kittel. Soortgelijke mechanismen zijn ook aan het werk in menselijke cellen.
Robert Kittel en Tobias Langenhan zijn ook lid van een onderzoekseenheid die wordt gefinancierd door Deutsche Forschungsgemeinschaft (DFG FOR 2149), die het signaalgedrag van adhesie-GPCR's bestudeert. De huidige studie maakt gebruik van de goede experimentele toegankelijkheid van Drosophila om nieuwe technologieën sneller in een biomedische context te brengen. Hierdoor kunnen voor het eerst basale moleculaire mechanismen worden beschreven. Deze mechanismen moeten nu worden bestudeerd in andere organismen en fysiologische contexten in samenwerking met andere wetenschappers.
 Arctisch zee-ijs kan niet terugveren
Arctisch zee-ijs kan niet terugveren De delen van een tarweplant
De delen van een tarweplant  First things first:om de klimaatdoelstellingen te halen, we kunnen de lagere stappen van de mitigatiehiërarchie niet overslaan
First things first:om de klimaatdoelstellingen te halen, we kunnen de lagere stappen van de mitigatiehiërarchie niet overslaan NASA verkent onze veranderende zoetwaterwereld
NASA verkent onze veranderende zoetwaterwereld De ongelijkheid in blootstelling aan luchtvervuiling blijft bestaan in Massachusetts
De ongelijkheid in blootstelling aan luchtvervuiling blijft bestaan in Massachusetts
Hoofdlijnen
- Welk enzym voegt nucleïnezuren toe aan de DNA-keten?
- De nadelen van melkzuurvergisting
- Vacuoles: definitie, functie, structuur
- Bij voetbalsucces draait alles om vaardigheid:studeren
- Genetisch hulpmiddel dat een soort onder VN-beoordeling kan veroordelen
- Hoe beïnvloedt DNA-replicatie je lichaam?
- Sociale gevoeligheid:leider-volger dynamiek van invloedrijke individuen in een sociale groep
- Veldonderzoek heeft tot doel de verspreiding van door teken overgedragen ziekten in het Midwesten te vertragen
- Wat gebruiken chloroplasten om glucose te maken?
 Lokale aanjagers van versterkte Arctische opwarming
Lokale aanjagers van versterkte Arctische opwarming Om gendergelijkheid te bereiken, we moeten eerst onze onbewuste vooroordelen aanpakken
Om gendergelijkheid te bereiken, we moeten eerst onze onbewuste vooroordelen aanpakken Verrassende ontdekking van spinnenhaar kan leiden tot sterkere lijmen
Verrassende ontdekking van spinnenhaar kan leiden tot sterkere lijmen Beyond EPA's Clean Power-beslissing:klimaatactievenster zou al in 2023 kunnen sluiten
Beyond EPA's Clean Power-beslissing:klimaatactievenster zou al in 2023 kunnen sluiten Er is meer dan genoeg zonne-energie om aan de energiebehoeften te voldoen - het probleem is om het op te slaan
Er is meer dan genoeg zonne-energie om aan de energiebehoeften te voldoen - het probleem is om het op te slaan Het werk van wetenschappers kan een antwoord bieden op het mysterie van Mars
Het werk van wetenschappers kan een antwoord bieden op het mysterie van Mars Onderzoekers zien positieve veranderingen in de politie na legalisatie van cannabis
Onderzoekers zien positieve veranderingen in de politie na legalisatie van cannabis AI gebruiken om vooringenomenheid in sociale media en nieuws af te leiden
AI gebruiken om vooringenomenheid in sociale media en nieuws af te leiden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com