
Wetenschap
Een vis in alle smaken
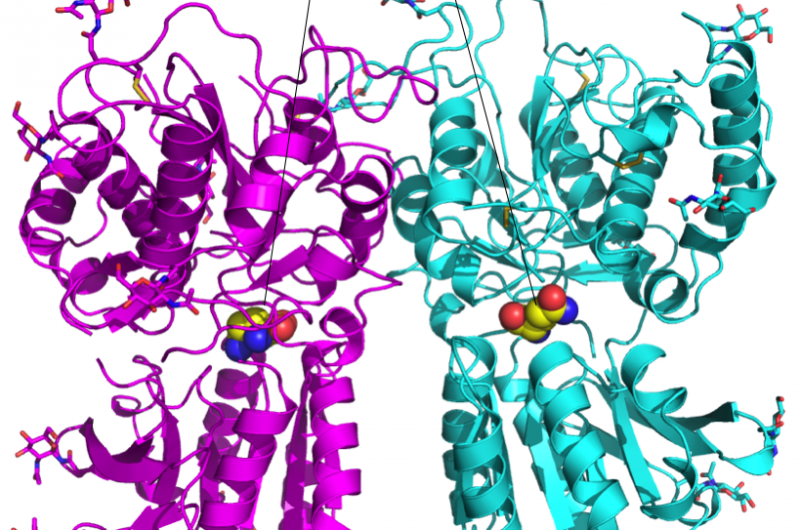
Figuur 1:kristalstructuur van de smaakreceptor T1r2-T1r3 ligand bindend domein heterodimeer. Krediet:Okayama University
Receptoren zijn hoe het lichaam zijn omgeving waarneemt. Na de binding van een ligand, een receptor zal een reeks gebeurtenissen initiëren die een reactie uitlokt. Ons reuksysteem is afhankelijk van ongeveer 400 receptoren om ons reukvermogen te geven. Smaak, echter, werkt met een veel kleiner aantal:de combinatie van slechts drie leden van de smaakreceptor type 1 (T1r) familie kan een breed scala aan zoete en hartige smaken bij mensen detecteren.
"T1r-heterodimeren kunnen de meeste zoete en umami-smaakstoffen waarnemen, " zegt Prof. Junichi Takagi van de Universiteit van Osaka. "Om deze perceptie te begrijpen, we keken naar de atomaire structuur van het heterodimeer."
Ons lichaam voelt een smaak wanneer een aminozuur van het voedsel zich bindt aan een heterodimeer van twee T1r-leden. Takagi is een expert in structurele biologie die de fysieke conformaties van receptoren bestudeert na binding aan hun liganden.
"De lock-and-key-theorie verklaart de meeste ligand-receptorbindingen. T1r is ongebruikelijk omdat deze theorie niet van toepassing lijkt te zijn. We dachten dat het een interessant onderzoek zou zijn."
Takagi werd benaderd door prof. Atsuko Yamashita van de universiteit van Okayama, die al jaren de T1r2-T1r3-heterodimeer van medaka-vissen bestudeerde. Dit heterodimeer bindt zich aan een breed scala aan aminozuren voor de perceptie van hartige smaken. Om de structuur op atomair niveau te meten, ze gebruikten zowel de expertise van Takagi als de synchrotronstralingsapparatuur bij RIKEN SPring-8 in Japan.
Het onderzoeksteam ontdekte dat de heterodimeerstructuur ongeveer hetzelfde was, ongeacht de aminozuurbinding, maar de affiniteit voor het aminozuur werd verzekerd samen met de shell-gestructureerde watermoleculen rond het aminozuur. Deze eigenschap zou kunnen verklaren hoe een enkele heterodimeer kan binden aan een reeks liganden.
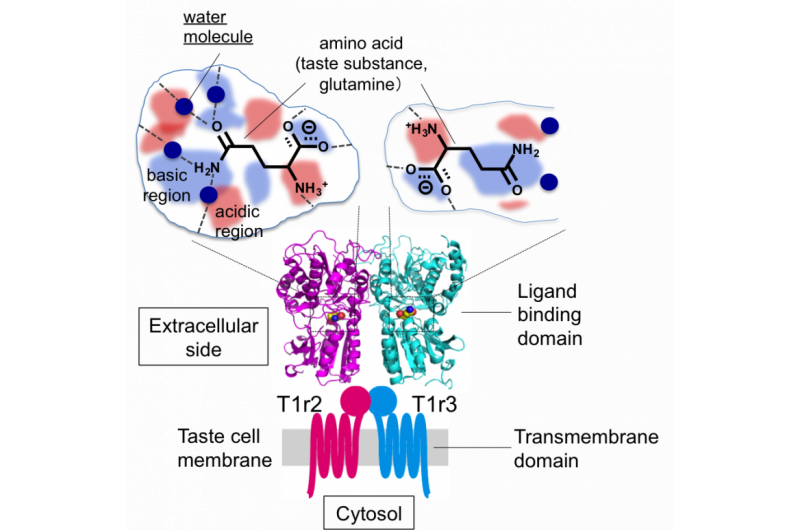
Figuur 2:Algehele structuur van de smaakreceptor en schematische tekening van de smaak-stof bindende zakken. Krediet:Okayama University
"We ontdekten dat de ruimte waarin het ligand T1r2 bindt veel groter is dan het ligand zelf. Deze grotere ruimte zou het gestructureerde water kunnen verklaren, " zei Yamashita. "De ruimte in de lock-and-key-receptoren is veel kleiner."
Een vergelijkbare eigenschap wordt gevonden in receptoren die verschillende soorten medicijnen doorgeven, wat suggereert dat dit mechanisme constant kan zijn voor niet-specifieke receptoren.
Hoewel de vorming van het heterodimeer noodzakelijk is voor waarneming, de bevindingen gaven aan dat T1r2 verantwoordelijk was voor het detecteren van verschillende aminozuren en dat binding aan T1r3 geen directe rol speelde bij het herkennen van smaken.
Ter voorbereiding van de receptoren, de groep koos ervoor om de medaka-vis T1r2-T1r3 heterodimeer te bestuderen boven de menselijke versie. Nog, omdat de T1r-familie universeel is in dieren op een hoger niveau, deze bevindingen zouden een informatief model moeten vormen voor smaaksensatie bij mensen.
 Protocell-gasten ontvluchten het nest
Protocell-gasten ontvluchten het nest Wetenschappers maken onderdelen van titanium met behulp van additieve technologieën
Wetenschappers maken onderdelen van titanium met behulp van additieve technologieën Wetenschappers ontwikkelen fagocytische protocellen die in staat zijn tot gerichte afgifte van enzymen
Wetenschappers ontwikkelen fagocytische protocellen die in staat zijn tot gerichte afgifte van enzymen Onderzoekers programmeren biomaterialen met logische poorten die therapieën vrijgeven als reactie op omgevingstriggers
Onderzoekers programmeren biomaterialen met logische poorten die therapieën vrijgeven als reactie op omgevingstriggers Non Neutral Atoms Examples
Non Neutral Atoms Examples
 Gegevens van mobiele telefoons in combinatie met riooltesten tonen patronen in drugsgebruik
Gegevens van mobiele telefoons in combinatie met riooltesten tonen patronen in drugsgebruik Brandvriendelijk weer om terug te keren naar Noord-Californië
Brandvriendelijk weer om terug te keren naar Noord-Californië Veranderende temperaturen helpen de maïsproductie in de VS - voorlopig
Veranderende temperaturen helpen de maïsproductie in de VS - voorlopig Het wiebelen van de maan zal kustoverstromingen intensiveren:dit betekent dat voor Australië
Het wiebelen van de maan zal kustoverstromingen intensiveren:dit betekent dat voor Australië Loodisotopen een nieuw hulpmiddel voor het volgen van steenkoolas
Loodisotopen een nieuw hulpmiddel voor het volgen van steenkoolas
Hoofdlijnen
- De voordelen van het gebruik van Sticky End Enzymen
- Nieuwe vliegsoort in Central Park krijgt bijnaam CCNY-professoren
- Wilgenroosje:de roze pionier
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Duizenden pinguïnkuikens verhongeren op Antarctica
- De wetenschap achter waarom sommige mensen van dieren houden en anderen niets kan schelen
- Chemische stoffen gebruikt in DNA-analyse
- leeuwen, chimpansees, haaien krijgen extra bescherming onder VN-verdrag
- Hoe maak je een glad endoplasmatisch reticulum uit klei
- Het uithongeren van tuberculose van suikers kan een nieuwe manier zijn om het te bestrijden
- Onderzoekers hopen dat een robo-neus K-9-officieren een pauze kan geven

- Volgorde van structuur voorspellen

- Nieuwe NIST-gegevens ter ondersteuning van de productie en opslag van fascinerende medicatie
- Nieuw composietmateriaal dat zichzelf kan afkoelen onder extreme temperaturen

 Kabelbanen kunnen verkeersproblemen in Australië verlichten
Kabelbanen kunnen verkeersproblemen in Australië verlichten Kun je gezouten zonnebloempitten aan vogels voeren?
Kun je gezouten zonnebloempitten aan vogels voeren?  Amerikaanse studenten beloven toekomstig salaris om schulden te voorkomen
Amerikaanse studenten beloven toekomstig salaris om schulden te voorkomen Chemicaliën gebruikt in warmtepakketten
Chemicaliën gebruikt in warmtepakketten  Maritieme sensor krijgt grip op zout
Maritieme sensor krijgt grip op zout Catch-22:strengere grenshandhaving kan corruptie van agenten vergroten
Catch-22:strengere grenshandhaving kan corruptie van agenten vergroten Soorten organellen
Soorten organellen Oceaanactiviteit is de belangrijkste controller van zomermoessons
Oceaanactiviteit is de belangrijkste controller van zomermoessons
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

