
Wetenschap
Op benzeen gebaseerde sondes markeren twee verborgen bindingsplaatsen op een doelwit tegen kanker
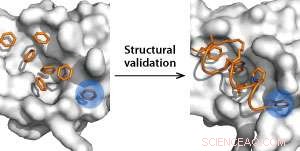
Binding pocket detectie met behulp van benzeen moleculen als probes (links) en structurele validatie met behulp van geniete peptiden (rechts). Krediet:Y.S. Tan et al.
In de zoektocht naar nieuwe kankertherapieën, A * STAR-onderzoekers hebben een computationele strategie bedacht die voorheen onbekende bindingsplaatsen of 'zakken' op medicijndoelen blootlegt.
Er zullen waarschijnlijk effectievere kankerbehandelingen voortkomen uit de pijplijn voor de ontwikkeling van geneesmiddelen. De ontdekking van kankergeneesmiddelen hangt af van het identificeren en karakteriseren van bindingszakken in doeleiwitten. Typisch, deze evaluatie maakt gebruik van computationele technieken die afhankelijk zijn van statische eiwitstructuren. Echter, eiwitten hebben een inherente flexibiliteit die de neiging veroorzaakt om van vorm te veranderen bij contact met de medicijnen. Bepaalde bindingsholtes blijven ondetecteerbaar tenzij ze een interactie aangaan met een geschikte stof en, daarom, worden gemist door conventionele simulaties. Deze verborgen zakken, echter, zijn meestal waterafstotende of hydrofobe locaties die alleen opengaan als er stoffen met een lage polariteit zijn.
Om dit aan te pakken, Yaw Sing Tan en Chandra Verma van het Bioinformatics Institute hebben een op sonde gebaseerde methode ontwikkeld die ligand-mapping moleculaire dynamica (LMMD) wordt genoemd. Ze gebruikten deze techniek om verborgen bindingsholtes te zoeken in het antikanker-doelwiteiwit MDM2. De resulterende voorspellingen werden experimenteel gevalideerd door langdurige medewerkers van A*STAR's p53 Laboratory and Institute of Chemical and Engineering Sciences, evenals structurele biologen van de Newcastle University, VK.
Tan legt uit dat hij deze op probes gebaseerde methode aanvankelijk had ontworpen voor een ander doeleiwit en deze met succes had gebruikt om een verborgen bindingspocket te vinden die in conventionele simulaties gesloten bleef. "We hebben toen besloten om deze benadering toe te passen op MDM2 om te zien of we voorheen onbekende bindingsplaatsen konden ontdekken die de potentie van bestaande MDM2-remmers zouden kunnen verbeteren, " hij voegt toe.
Benzeenmoleculen gebruiken als hydrofobe pocketdetectiesondes, de onderzoekers identificeerden computationeel twee nieuwe bindingsplaatsen op MDM2. "We waren verheugd om te zien dat deze plaatsen heel dicht bij de bindingsholte van het tumorsuppressor-eiwit p53 liggen, " zegt Tan.
Verder, de onderzoekers verwachten dat de nieuw gevonden sites zullen leiden tot krachtigere geniete peptiden - dit zijn aminozuurhelices die chemisch zijn gestabiliseerd door een koolwaterstofketen die recentelijk naar voren zijn gekomen als krachtige p53-activatoren. Bijgevolg, ze creëerden geniete peptiden van analogen waarvan bekend is dat ze MDM2 stevig binden en p53 reactiveren, en bepaalden de affiniteit van deze peptiden voor MDM2. Hun simulaties toonden aan dat de peptiden MDM2 sterker bonden dan p53 in de pockets en overeenkwamen met biofysische en röntgenkristallografie-experimenten.
"Deze methode zou kunnen worden gebruikt om andere antikanker-eiwitdoelen te ondervragen om nieuwe bindingsplaatsen te ontdekken die het doelwit kunnen zijn voor remming, ", zegt Tan. Het team werkt nu aan het uitbreiden van het bereik van LMMD-sondes naar andere ligandtypen.
 Een soort mos kan medisch effectiever blijken te zijn dan hennep
Een soort mos kan medisch effectiever blijken te zijn dan hennep Een startup laten groeien met een grote impact van een kleine schimmel
Een startup laten groeien met een grote impact van een kleine schimmel Nieuwe lijm plakt gemakkelijk, houdt goed, en is een gas om uit elkaar te trekken
Nieuwe lijm plakt gemakkelijk, houdt goed, en is een gas om uit elkaar te trekken Verbeterd begrip van industriële elektrodeprocessen
Verbeterd begrip van industriële elektrodeprocessen Gebruik van het kookpunt Elevation
Gebruik van het kookpunt Elevation
 Onderzoek naar de fijne kneepjes van het verwijderen van ozon door loofbossen
Onderzoek naar de fijne kneepjes van het verwijderen van ozon door loofbossen Onderzoek naar verbanden tussen drie aardbevingen in Nieuw-Zeeland
Onderzoek naar verbanden tussen drie aardbevingen in Nieuw-Zeeland Overstromingen komen niet willekeurig voor, dus waarom plannen we nog steeds alsof zij dat doen?
Overstromingen komen niet willekeurig voor, dus waarom plannen we nog steeds alsof zij dat doen? Wat is de belangrijkste primaire producent in het mariene ecosysteem?
Wat is de belangrijkste primaire producent in het mariene ecosysteem?  Boeren in Myanmar gaan tegen de stroom in met apps
Boeren in Myanmar gaan tegen de stroom in met apps
Hoofdlijnen
- Het verschil tussen hoe interne en externe regulatoren werken
- Welke vormen over het midden van een cel nabij het einde van Telophase?
- Symbiose en celevolutie:Lynn Margulis en de oorsprong van eukaryoten
- Dahls paddenkopschildpad bedreigd door versnipperd leefgebied, krimpende bevolking
- Langoustines hongeren naar kwallen gevangen op camera
- Waarom verplaatsen chloroplasten zich in Elodea?
- Kan iemand zich herinneren dat hij geboren is?
- Wat is er nodig voor de glycolyse?
- Wat is de functie van de promotor in de transcriptie van DNA?
- Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen

- Nieuw katalysatorcomposiet vermindert het gebruik van zeldzame aardelementen
- Welke vormen wanneer twee of meer atomen worden gecombineerd?

- Kenmerken van ionische en covalente verbindingen
- Draagbare elektronica voor continue cardiale, ademhalingsbewaking

 Toegevoegde Arctische gegevens tonen aan dat de opwarming van de aarde niet is onderbroken
Toegevoegde Arctische gegevens tonen aan dat de opwarming van de aarde niet is onderbroken Hoe planten met sporen zich voortplanten
Hoe planten met sporen zich voortplanten  Je kleding wassen kan Arctische microplasticvervuiling veroorzaken
Je kleding wassen kan Arctische microplasticvervuiling veroorzaken Wat is precies een zwart gat?
Wat is precies een zwart gat? Is de ziekte van Lyme gemaakt als een biowapen?
Is de ziekte van Lyme gemaakt als een biowapen?  Stoffen die de impact voor wetenschapsprojecten absorberen
Stoffen die de impact voor wetenschapsprojecten absorberen  Hoe Joule naar Mol
Hoe Joule naar Mol  Wil je meer vrouwen aannemen? Breid je shortlist uit
Wil je meer vrouwen aannemen? Breid je shortlist uit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | German | Dutch | Danish | Norway | Italian | Swedish |

-
Wetenschap © https://nl.scienceaq.com

