
Wetenschap
Hoe bacteriën bacteriofagen in vivo ontwijken
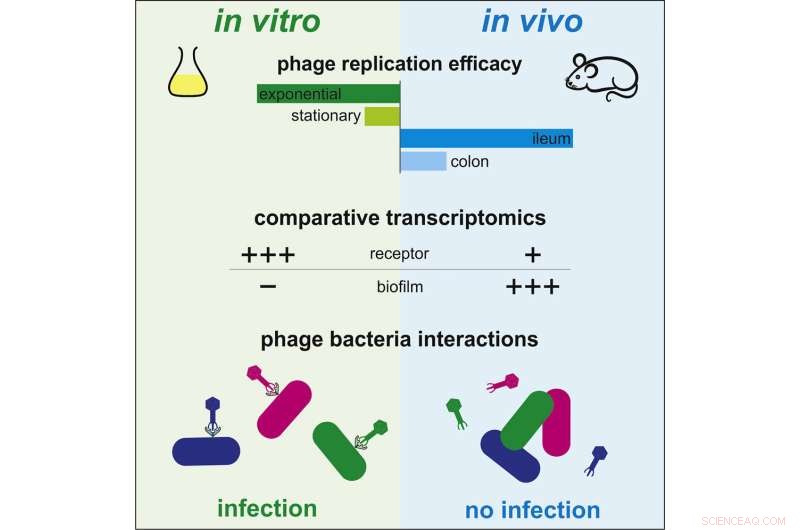
Grafisch abstract. Krediet:Cell Host &Microbe (2022). DOI:10.1016/j.chom.2022.03.014
Faagtherapie, waarbij virussen worden gebruikt die bekend staan als bacteriofagen om bacteriële infecties te behandelen, is een langdurige medische procedure waarvan de werkingsmechanismen nog steeds slecht worden begrepen. Wetenschappers van het Institut Pasteur en CNRS hebben in vivo in een muizenmodel aangetoond dat bacteriën in staat zijn hun genexpressie te reguleren om de talrijke bacteriofagen in de darmomgeving te omzeilen. Dit onderzoek verklaart het verschil in de werkzaamheid van bacteriofaag tussen in vitro en in vivo omstandigheden. De bevindingen werden gepubliceerd in het tijdschrift Cell Host &Microbe op 13 april 2022.
Faagtherapie is een medische benadering waarbij bacteriële infectieziekten worden behandeld met behulp van het natuurlijke vermogen van bepaalde virussen, bekend als bacteriofagen, om bacteriën te doden die ze specifiek herkennen. Een significante afname in het gebruik van deze therapeutische strategie die meer dan 100 jaar geleden werd ontdekt, werd waargenomen in het Westen na de ontwikkeling van antibiotica. Geconfronteerd met een alarmerende toename van het aantal infecties veroorzaakt door antibioticaresistente bacteriën en het zorgwekkende vooruitzicht om zonder behandelingsopties te blijven, proberen wetenschappers licht te werpen op het werkingsmechanisme van bacteriofagen.
Bacteriën en bacteriofagen zijn de meest voorkomende entiteiten in de menselijke darmflora. Hoewel bacteriofagen bacteriën doden, bestaan de twee antagonistische populaties naast elkaar in een evenwicht in de darm.
Tot nu toe waren er onvoldoende wetenschappelijke gegevens beschikbaar om te begrijpen hoe faagtherapie in vivo werkt. Interacties tussen bacteriën en bacteriofagen zijn daarentegen uitgebreid in vitro bestudeerd. In deze omstandigheden infecteren bacteriofagen bacteriën snel, repliceren en vernietigen ze bacteriën, terwijl ze nieuwe virussen vrijgeven die andere bacteriën kunnen infecteren. De waargenomen dynamiek tussen deze twee micro-organismen is echter heel verschillend in de darm van zoogdieren. Sommige bacteriofagen die effectief zijn in kweekmedium, zijn totaal ondoeltreffend in de darmomgeving.
Om dit verschil te begrijpen, besloten wetenschappers van het Institut Pasteur en CNRS om het genexpressieprofiel, of transcriptoom, van de bacterie Escherichia coli in beide contexten te vergelijken:kweekmedia en de darm. Met behulp van deze methode onthulden ze genetische reguleringen die kenmerkend zijn voor de aanpassing van de bacterie aan de darmomgeving.
Door de genen die betrokken zijn bij deze aanpassing nauwkeurig te onderzoeken, onthulden ze vier genen die de gevoeligheid van de bacterie voor bacteriofagen moduleren. "We hebben vastgesteld dat bepaalde genen die nodig zijn voor infectie door bacteriofagen minder tot expressie worden gebracht in de darm dan in vitro, waardoor bacteriën worden beschermd tegen bacteriofagen", zegt Laurent Debarbieux, hoofd van de Bacteriofaag, Bacterium, Host Unit van het Institut Pasteur (CNRS joint unit) en laatste auteur van de studie. De wetenschappers konden hun theorie verifiëren door de expressie van één bepaald gen te elimineren. Ze merkten op dat de bacteriële gevoeligheid voor een bacteriofaag significant was verminderd. Dientengevolge kunnen bacteriën in de darmen predatie door bacteriofagen weerstaan door de expressie van bepaalde genen te moduleren in plaats van hun genoom te muteren.
Deze studie toont daarom aan dat de omgeving een overheersende rol speelt in interacties tussen bacteriën en bacteriofagen. Deze bevindingen maken de weg vrij voor een beter gebruik van bacteriofagen voor therapeutische doeleinden.
 Hoe maak je een zelfgemaakte thermosfles voor een Science Fair-project
Hoe maak je een zelfgemaakte thermosfles voor een Science Fair-project  Grootschalige bereiding van op polymeer gebaseerde fosforescentie bij kamertemperatuur via klikchemie
Grootschalige bereiding van op polymeer gebaseerde fosforescentie bij kamertemperatuur via klikchemie Protonen, neutronen en elektronen Wetenschapsprojecten
Protonen, neutronen en elektronen Wetenschapsprojecten Wat een kristal onthult over de verwerking van nucleair materiaal
Wat een kristal onthult over de verwerking van nucleair materiaal Hoeveel zout heeft het nodig om een ei in water te drijven?
Hoeveel zout heeft het nodig om een ei in water te drijven?
Hoofdlijnen
- Waarom bevatten niet alle plantencellen chloroplasten?
- Vogelgriep:Nederlandse boeren moeten pluimvee binnen houden
- Belangrijke verbeteringen onthuld op Closer to Van Eyck webapplicatie
- Studie waarschuwt dat slangenschimmelziekte een wereldwijde bedreiging kan zijn
- Wat is urushiol?
- Hoeveel mieren zijn er op aarde? 20 quadriljoen, zegt onderzoek
- Hoe is het schrijven geëvolueerd?
- Waarom wordt magnesiumchloride gebruikt in PCR?
- Zebra-poepwetenschap verbetert de inspanningen voor natuurbehoud
- Wat doet ethanol in een DNA-extractie?

- Wat is een positieve controle in de microbiologie?

- Is de tweekamerige geest geëvolueerd om het moderne menselijke bewustzijn te creëren?

- Waarom je meer sympathie zou moeten hebben voor zeemeeuwen en hoe je kunt voorkomen dat ze je fiches stelen

- Lijst met celorganellen en hun functies

 Team laat zien dat kleine frequentiekammen betrouwbare meetinstrumenten zijn
Team laat zien dat kleine frequentiekammen betrouwbare meetinstrumenten zijn Eerste observatie ooit van interactie tussen tijdkristallen
Eerste observatie ooit van interactie tussen tijdkristallen NASA's zelfrijdende Perseverance Mars-rover neemt het stuur over
NASA's zelfrijdende Perseverance Mars-rover neemt het stuur over Hoe gecoate houtproducten langer meegaan?
Hoe gecoate houtproducten langer meegaan? Secundaire bossen bieden ontbossingsbuffer voor oerbossen
Secundaire bossen bieden ontbossingsbuffer voor oerbossen Grote oceaanobservatiesatelliet begint wetenschappelijke gegevens te leveren
Grote oceaanobservatiesatelliet begint wetenschappelijke gegevens te leveren Professor volgt middeleeuwse winden van (klimaat)verandering
Professor volgt middeleeuwse winden van (klimaat)verandering Beschrijving van de anatomie van een menselijke vinger
Beschrijving van de anatomie van een menselijke vinger
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

