
Wetenschap
Hoe het lichaam een essentieel aminozuur waarneemt
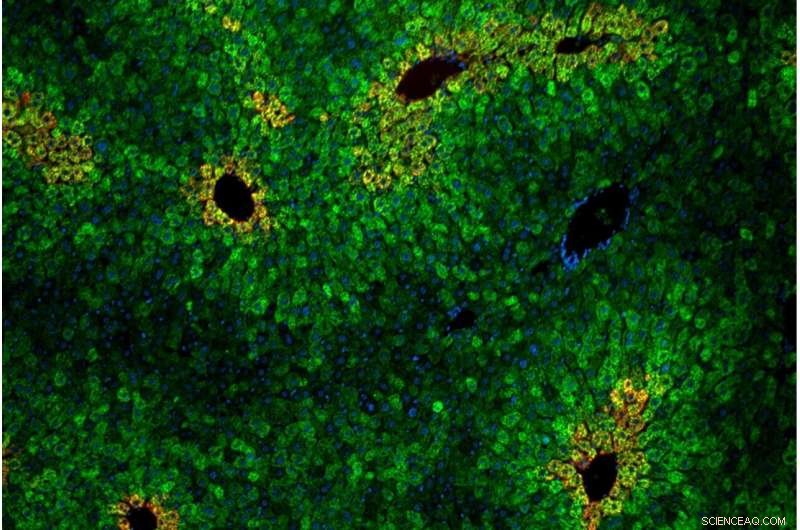
Cellen in de lever zijn gerangschikt in "lobben" van concentrische ringen van hepatocyten. Levercellen in de lobben variëren in hun gevoeligheid voor het essentiële aminozuur leucine. Credit Andrew Cangelosi/Whitehead Institute
Een nieuw artikel van onderzoekers van het Whitehead Institute onthult hoe muizen een essentieel aminozuur voelen, leucine genaamd, dat veel mensen krijgen door het eten van vis, eieren of noten. Uiteindelijk zou het werk kunnen bijdragen aan onderzoek naar het maken van medicijnen die gericht zijn op specifieke delen van een belangrijke metabole en groeiregulerende route, de mTOR-route genaamd, om sommige vormen van kanker of andere metabole ziekten te behandelen.
Leucine is nodig om spieren in het lichaam op te bouwen en te herstellen; als het lichaam geen toegang heeft tot dit aminozuur uit voedsel, is de beste manier om het metabolisme in bepaalde weefsels uit te schakelen totdat de hulpbron is hersteld. Daarom is het detecteren van leucine belangrijk - als het metabolisme van het dier zoals gewoonlijk zonder leucine blijft draaien, ontdekten de onderzoekers dat het dier zichzelf in wezen kannibaliseert, waardoor de vet- en spiervoorraden worden uitgeput.
Voormalig Whitehead Institute-onderzoeker Andrew Cangelosi leidde de studie terwijl hij zijn Ph.D. in het lab van voormalig Whitehead Institute-lid David Sabatini. "Mensen weten al heel lang dat aminozuren de mTOR-route heel sterk reguleren, maar toen ik in het laboratorium begon, was het een grote zwarte doos - we begonnen net te begrijpen wat ze aan het doen waren en hoe dat gebeurde," zei Cangelosi.
In de afgelopen 15 jaar hebben onderzoekers - van het Whitehead Institute en elders - enkele van de mechanismen van hoe aminozuren de route beïnvloeden, uit elkaar gehaald. "Een van de grote inzichten die hieruit voortkwamen, was dat de route om zeer specifieke aminozuren gaf," zei Cangelosi. Er zijn 20 aminozuren die door zoogdiercellen worden gebruikt om eiwitten te maken, en een handvol hiervan, waaronder leucine, heeft een veel sterker effect op de mTOR-route dan andere aminozuren.
In een paper uit 2014 ontdekten onderzoekers van het Whitehead Institute dat een familie van eiwitten, de Sestrins genaamd, verantwoordelijk was voor het communiceren van de aanwezigheid van leucine aan de mTOR-route, met name mTORC1, het nutriëntendetectiecomplex. (Het eiwit mTOR is een essentiële component in twee verschillende eiwitcomplexen, mTORC1 en mTORC2, die verschillende rollen in het lichaam spelen. mTORC1, is gevoelig voor voedingsstoffen en regelt de eiwitsynthese en celgroei als reactie, terwijl mTORC2 betrokken is bij cellulaire signalering en metabole regulatie.) In gekweekte cellen remmen Sestrin1 en Sestrin2 de mTORC1-signalering door interactie met en onderdrukking van een eiwitcomplex genaamd GATOR2. Wanneer GATOR2 wordt onderdrukt, kan de mTOR-route niet actief blijven.
Dit onderzoek vond echter plaats in celcultuur, dus er bleven vragen over hoe dit mechanisme zich afspeelde bij levende muizen. "Het bestuderen van een homogene celpopulatie in een gerecht is heel anders dan in een dier", zei hij. "We wilden echt begrijpen wat de resultaten in celcultuur betekenden voor wat leucine in het lichaam doet."
Cangelosi bracht zijn afstudeerjaren door met het ontwikkelen van muismodellen zonder Sestrins om te testen of de eiwitten in diermodellen dezelfde rol speelden als in een gerecht. Vervolgens voerde hij deze muizen, evenals controlemuizen, een dieet dat volledig vrij was van leucine. Wanneer normale muizen geen leucine kregen, konden ze dit compenseren door de mTOR-route uit te schakelen en het metabolisme te vertragen / stoppen. Maar toen muizen zonder Sestrins (en dus het vermogen om leucine te voelen) het leucinevrije dieet kregen, verloren ze drastisch vet en spiermassa.
Net als in celkweek was de leucine-detectieroute afhankelijk van het eiwitcomplex GATOR2 en was specifiek voor mTORC1 (niet mTORC2). Een nieuw inzicht uit de diermodellen was dat de detectie van leucine zich concentreerde in specifieke delen van de lever. Deze zones, leverlobules genoemd, zijn hexagonale opstellingen van cellen die het voedingsrijke bloed van de darm door het filtersysteem van de lever en in de bloedsomloop van het lichaam leiden.
"De lever ziet in wezen alles wat je eet voordat de rest van je lichaam dat doet," zei Cangelosi. "Het fungeert als een soort toegangspoort tot voedingsstoffen in het lichaam, en verschillende cellen in de lever hebben verschillende eigenschappen, afhankelijk van hun rangschikking. Het lijkt er absoluut op dat het lichaam de Sestrins gebruikt om de mTOR-route gevoelig of niet gevoelig te maken voor leucine, afhankelijk van waar het moet zijn of niet."
Het inzicht dat zelfs in de lever niet alle cellen op dezelfde manier reageren op de aanwezigheid of afwezigheid van leucine, suggereert een complexere kijk op dit metabolische proces, zei Cangelosi. "Dit wijst op een heel nieuwe manier waarop het hele pad in het lichaam werkt - dat het in verschillende contexten en in verschillende omgevingen anders is bedraad, zodat de cellulaire metabolische functie daadwerkelijk kan worden gedicteerd door de specifieke omgeving van de cel of het weefsel."
Hoewel sommige medicijnen zijn ontworpen om vetverlies te veroorzaken, benadrukte Cangelosi dat het vetverlies dat wordt waargenomen bij muizen die ongevoelig zijn voor leucine, niet gezond is. "Ik denk niet dat het als nuttig kan worden beschouwd", zei hij. "De mTOR-route is een proces van behoud van voedingsstoffen dat belangrijk is, en de muizen verloren ook veel spiermassa. Dit is geen gezonde herprogrammering van de stofwisseling - het was een behoorlijk slechte reactie voor de muizen."
Cangelosi's onderzoek zou therapieën echter op andere manieren kunnen informeren. Begrijpen hoe mTOR-gerelateerde processen anders verlopen in verschillende celtypen, zou uiteindelijk kunnen leiden tot therapieën voor sommige kankers en andere ziekten die het celmetabolisme beïnvloeden. Op dit moment lopen mTOR-gerichte medicijnen - met name die op basis van het immunosuppressieve medicijn rapamycine - vaak vast in klinische onderzoeken vanwege een gebrek aan specificiteit.
"Wanneer [mTOR-gerichte medicijnen] aan mensen worden gegeven, komt het er altijd op neer dat ze zo algemeen alles afsluiten wat mTOR doet," zei Cangelosi. "Als we een beter begrip hebben van hoe we ons specifiek op verschillende mTOR-complexen kunnen richten - en dit kan een lange weg zijn, maar als we manieren kunnen identificeren om ons te richten op specifieke delen van het lichaam, zelfs specifieke cellen van het lichaam - die belangrijk voor de bepaalde ziekte of pathologie die we proberen te behandelen, deze zouden van cruciaal belang zijn om de negatieve bijwerkingen weg te werken die dit al zo lang in de kliniek beperken."
Het onderzoek is gepubliceerd in Science .
 Nieuwe tool om polymeereigenschappen te voorspellen
Nieuwe tool om polymeereigenschappen te voorspellen Hoe molaire oplosbaarheid te berekenen uit KSP?
Hoe molaire oplosbaarheid te berekenen uit KSP?  Litouwen ontwikkelen een afhaalmaaltijdenpakket dat volledig plasticvrij is
Litouwen ontwikkelen een afhaalmaaltijdenpakket dat volledig plasticvrij is Cementhydratatie visualiseren op moleculair niveau
Cementhydratatie visualiseren op moleculair niveau Samenstellingsontwerp van legeringen met meerdere componenten door screening met hoge doorvoer
Samenstellingsontwerp van legeringen met meerdere componenten door screening met hoge doorvoer
 Onderzoeker waarschuwt China's programma voor het meest risicovolle milieuproject in de geschiedenis
Onderzoeker waarschuwt China's programma voor het meest risicovolle milieuproject in de geschiedenis Soorten grote wespen
Soorten grote wespen  Meer dan alleen walvisvoer:de invloed van krill op koolstofdioxide en het wereldwijde klimaat
Meer dan alleen walvisvoer:de invloed van krill op koolstofdioxide en het wereldwijde klimaat Studie:Activisme en burgerlijke ongehoorzaamheid helpen de wetenschap van klimaatverandering te communiceren
Studie:Activisme en burgerlijke ongehoorzaamheid helpen de wetenschap van klimaatverandering te communiceren Kunststoffen en stijgende kooldioxidegehaltes kunnen een gecombineerde bedreiging vormen voor het mariene milieu
Kunststoffen en stijgende kooldioxidegehaltes kunnen een gecombineerde bedreiging vormen voor het mariene milieu
Hoofdlijnen
- Hoe weet je lichaam het verschil tussen dominante en recessieve genen?
- Slapen spinnen? Onderzoek suggereert dat ze net als mensen kunnen snoozen
- Waarom neemt het DNA-gehalte toe tijdens interfase?
- Video:Op weg naar nul honger wereldwijd
- Een bouwsteen voor leverfitness op oudere leeftijd
- Genetici ontdekken nieuwe ondersoorten van wilde geiten via oud DNA
- Internationale concurrentiebenchmarks metagenomics-software
- Ja,
- Veldonderzoek heeft tot doel de verspreiding van door teken overgedragen ziekten in het Midwesten te vertragen
- Moeten we de natuur beschermen omwille van zichzelf? Voor zijn economische waarde? Omdat het ons gelukkig maakt? Ja

- Signaalmolecuul kan eiwitten in tarweplanten reguleren

- Wetenschappers onderzoeken de gevolgen voor de nationale veiligheid van genbewerking

- Jagen op ooien met dikhoornschapen zou meer trofeerammen kunnen opleveren

- Gestrande walvisachtigen? Daar is een app voor

 TVA controleert op gifstoffen uit steenkool bij de watervoorziening van Memphis
TVA controleert op gifstoffen uit steenkool bij de watervoorziening van Memphis Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen Antimicrobiële resistentie in het milieu veroorzaakt door slecht beheerd stedelijk afvalwater
Antimicrobiële resistentie in het milieu veroorzaakt door slecht beheerd stedelijk afvalwater Koolstof volgen van het oceaanoppervlak naar de schemerzone
Koolstof volgen van het oceaanoppervlak naar de schemerzone VS zou de overname van Qualcomm door Broadcoms kunnen blokkeren, ambtenaren waarschuwen
VS zou de overname van Qualcomm door Broadcoms kunnen blokkeren, ambtenaren waarschuwen Coronavirus:een wake-up call om het wereldwijde voedselsysteem te versterken
Coronavirus:een wake-up call om het wereldwijde voedselsysteem te versterken Disruptieve bio-engineering - verandert de manier waarop cellen met elkaar omgaan
Disruptieve bio-engineering - verandert de manier waarop cellen met elkaar omgaan Hoe Tear Gas te maken
Hoe Tear Gas te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

