
Wetenschap
Hoe poliovirus cellen van binnenuit overneemt
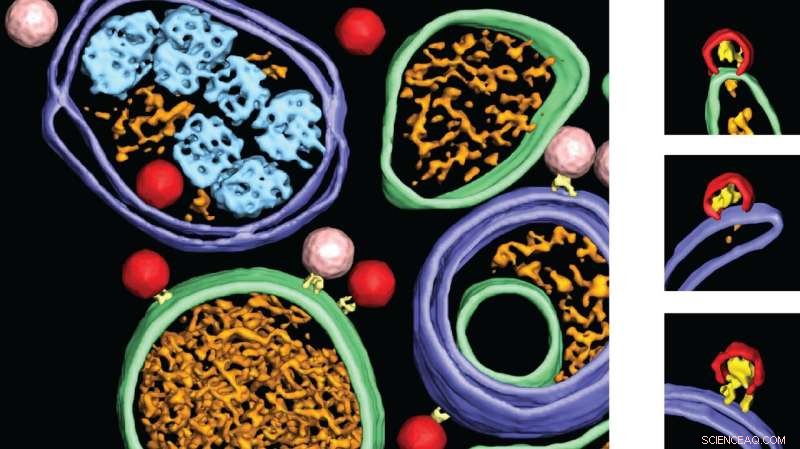
De linkerafbeelding laat zien hoe nieuw gevormde poliovirusdeeltjes (roze) worden geladen met het virusgenoom en veranderen in infectieuze virussen (rood). Rechts:als het celeiwit VPS34 wordt geremd, stopt de virusopbouw halverwege. Half gemaakte virusdeeltjes worden in rood weergegeven. Eén virusdeeltje is 30 nanometer (één nanometer is één miljoenste millimeter). Credit:Selma Dahmane, Universiteit van Umeå, Zweden
Voor het eerst kunnen onderzoekers van de Universiteit van Umeå, Zweden, nu laten zien hoe het gevreesde poliovirus zich gedraagt wanneer het een geïnfecteerde cel overneemt en de cel misleidt om nieuwe virusdeeltjes te produceren. Men dacht dat polio bijna uitgeroeid was, maar de infectie is nu herontdekt in Londen en New York.
"We hebben nu een heel ander begrip van hoe het virus werkt en dus betere mogelijkheden voor onderzoek om misschien nieuwe manieren te vinden om de voortgang van het virus in de toekomst te beteugelen", zegt Lars-Anders Carlson van de afdeling Medische Chemie en Biofysica in Umeå Universiteit.
Het gevreesde poliovirus behoort tot dezelfde grote familie, enterovirussen, als verschillende verkoudheden. Het is al enige tijd bekend dat enterovirussen de binnenkant van geïnfecteerden drastisch herschikken, maar het is niet precies bekend hoe, simpelweg omdat de technologie ons niet in staat heeft gesteld zo diep in de cellen te kijken. Dankzij de geavanceerde cryo-elektronenmicroscoop in Umeå hebben onderzoekers voor het eerst driedimensionale beelden kunnen maken van hoe het poliovirus zich vormt en menselijke cellen overneemt.
"We waren verrast om te zien hoe het virus processen in de cel transformeert die anders worden gebruikt om virussen te vernietigen om in plaats daarvan nieuwe virussen te produceren", zegt Lars-Anders Carlson.
De onderzoekers konden de plaats in de cel identificeren waar het poliovirus nieuwe virusdeeltjes vormt, door plaatsen met half-geassembleerde virussen te zien. Verrassend genoeg bleken deze 'virusfabriek' in de cel oppervlakken in de cel te zijn die leken op een verder normaal proces in de cel, autofagie. Autofagie is een relatief recent ontdekt proces in cellen dat het onderwerp was van de 2016 Nobelprijs. Normaal gesproken dient autofagie om deeltjes af te breken waar de cel vanaf wil, zoals virusdeeltjes. Maar het poliovirus slaagt erin om dit verdedigingsmechanisme tegen virussen te herprogrammeren om in plaats daarvan meer virussen te produceren.
De onderzoekers ontdekten dat vooral bepaalde eiwitten belangrijk zijn. Het VSP34-eiwit wordt door het virus gebruikt om nieuwe virusdeeltjes te bouwen. Toen de onderzoekers VSP34 remden, konden ze zien dat het virus nauwelijks hele virussen kon samenstellen, maar meestal slechts halve virusdeeltjes. Een ander belangrijk eiwit is ULK1, dat de aanmaak van virussen vertraagt. De onderzoekers konden zien dat de hoeveelheid virus explodeerde als dit eiwit werd geremd. Dit bevestigt de theorie dat het poliovirus deze "rem" afbreekt.
Zodra het virus zich in de cel heeft vermenigvuldigd, moeten de deeltjes worden vrijgegeven om nieuwe cellen te infecteren. Dit wordt gedaan door de deeltjes in kleine pakketjes vrij te geven, blaasjes genaamd. Ook hier deden de onderzoekers een verrassende ontdekking; er vindt een zorgvuldige sortering plaats van wat er in de blaasjes zit. Alleen virussen die correct zijn gevormd en het genetische materiaal van het virus dragen, worden in de blaasjes geplaatst, terwijl lege virusdeeltjes niet worden toegelaten. Op deze manier kan het virus zich efficiënter verspreiden.
"De nieuwe kennis die we leveren over de rol van autofagie bij virusvorming kan nieuwe inzichten opleveren voor de ontwikkeling van toekomstige antivirale middelen die vaccins kunnen aanvullen. We hebben goede redenen om aan te nemen dat onze bevindingen geldig zijn voor de grote groep virussen waartegen poliovirus behoort, enterovirussen. Er is geen vaccin tegen de meeste enterovirussen, maar een antiviraal middel dat inwerkt op het autofagiesysteem zou tegen veel van hen effectief kunnen zijn. Er is echter nog een lange weg te gaan", zegt Lars-Anders Carlson.
Polio is terecht een gevreesde ziekte die verlamming en de dood kan veroorzaken. Het poliovirus begint in de darmen, maar kan vervolgens het ruggenmerg aanvallen. Er is nog steeds geen remedie voor de ziekte, maar de enige manier om het te voorkomen is door je te laten vaccineren. In een groot deel van de wereld zijn vaccinatiecampagnes zo succesvol geweest dat de ziekte als vrijwel geëlimineerd wordt beschouwd. Polio blijft echter bestaan in sommige landen in Azië, Afrika en het Midden-Oosten. Het poliovirus wordt voornamelijk overgedragen via de ontlasting. In 2022 werd het virus opnieuw aangetroffen in rioolwater in New York en Londen. Bovendien heeft New York het eerste nieuwe geval in tien jaar gehad van een persoon die verlamd raakte door een polio-infectie.
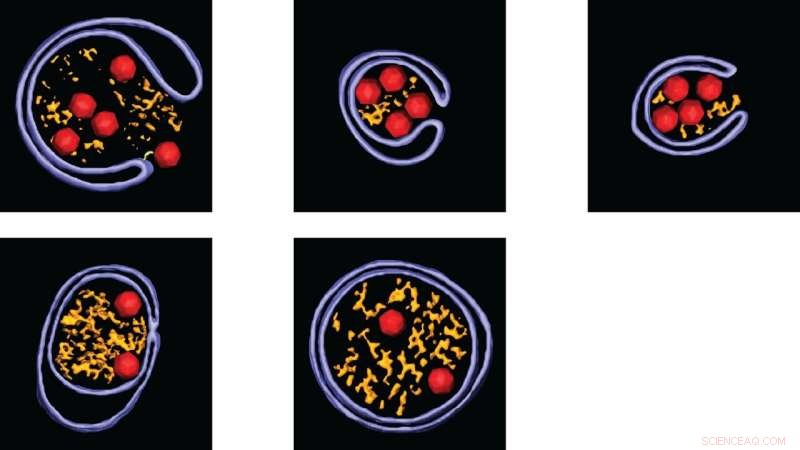
Wanneer nieuwe virusdeeltjes in kleine pakketjes (de zogenaamde vesicles) worden klaargemaakt voor vrijgave, zorgt het virus ervoor dat alleen die virusdeeltjes worden verpakt die met het virusgenoom zijn geladen en dus besmettelijk worden. Verschillende voorbeelden van dat proces worden getoond (besmettelijke deeltjes in rood, blaasjes in blauw). Credit:Selma Dahmane, Universiteit van Umeå, Zweden
De terugkeer van polio in ontwikkelde landen kan deels te wijten zijn aan een daling van de vaccinatiegraad, aangezien de ziekte als bijna uitgeroeid werd beschouwd, en ook aan de toenemende weerstand tegen vaccinatie.
De studie was een samenwerking met onderzoekers van de National Institutes of Health, VS, en Monash University, Australië. Het is gepubliceerd in het wetenschappelijke tijdschrift Nature Communications .
 Nieuwe kit maakt onderzoek naar microplastics in de oceaan mogelijk
Nieuwe kit maakt onderzoek naar microplastics in de oceaan mogelijk Zee-ijs veroorzaakte de Kleine IJstijd, vindt een nieuwe studie
Zee-ijs veroorzaakte de Kleine IJstijd, vindt een nieuwe studie Onderzoekers vinden ongebruikelijk fenomeen in wolken dat bliksemflits veroorzaakt
Onderzoekers vinden ongebruikelijk fenomeen in wolken dat bliksemflits veroorzaakt 4 redenen waarom een door gas geleid economisch herstel verschrikkelijk is, naïef idee
4 redenen waarom een door gas geleid economisch herstel verschrikkelijk is, naïef idee Gezondheidsvrees als moordenaar DR Congo-vulkaan as spuit
Gezondheidsvrees als moordenaar DR Congo-vulkaan as spuit
Hoofdlijnen
- Verrassende ontdekking - hoe de Afrikaanse tseetseevlieg echt je bloed drinkt
- De toekomst zaaien? Ark conserven zeldzaam, bedreigde planten
- De majestueuze orchidee uit Singapore genoemd ter ere van koningin Elizabeth
- Beoordeling van op SERS gebaseerde sensoren voor landbouwtoepassingen
- Wat is het principe van parsimony in de biologie?
- Kan lachen ziekten genezen?
- De locatie van ribosomen in een cel
- Kunnen windturbines en trekvogels naast elkaar bestaan?
- Burgerwetenschap kan trends in de vlinderpopulatie voorspellen
- Hoe komen de spermacellen in een stuifmeelkorrel aan bij de eicelklus in een plant-ovule?

- Coyotes zijn hier om te verblijven in Noord-Amerikaanse steden. Hoe je ze van een afstand kunt waarderen

- Dode bomen leven met schimmels

- Onderzoekers leggen live beelden vast van virus-infecterende cel
- Archaea: Structure, Characteristics & Domain
 A Killer Is Back: Heres Alles wat u moet weten over de recordbrekende mazelen Uitbraak
A Killer Is Back: Heres Alles wat u moet weten over de recordbrekende mazelen Uitbraak Sushi-achtige opgerolde 2D heterostructuren kunnen leiden tot nieuwe geminiaturiseerde elektronica
Sushi-achtige opgerolde 2D heterostructuren kunnen leiden tot nieuwe geminiaturiseerde elektronica Wat is een hypertonische oplossing?
Wat is een hypertonische oplossing?  Natuurlijk kapitaal sleutel tot wereldwijde welvaart, Economen uit Oxford waarschuwen
Natuurlijk kapitaal sleutel tot wereldwijde welvaart, Economen uit Oxford waarschuwen Locatie en omvang van koraalriffen wereldwijd in kaart gebracht met behulp van geavanceerde AI
Locatie en omvang van koraalriffen wereldwijd in kaart gebracht met behulp van geavanceerde AI Gletsjers in realtime observeren
Gletsjers in realtime observeren Factoren die de pH van water in Wetlands
Factoren die de pH van water in Wetlands NASA-satelliet vindt een wigvormige tropische storm Paulette
NASA-satelliet vindt een wigvormige tropische storm Paulette
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

