
Wetenschap
De celschildwacht die hepatitis B neutraliseert
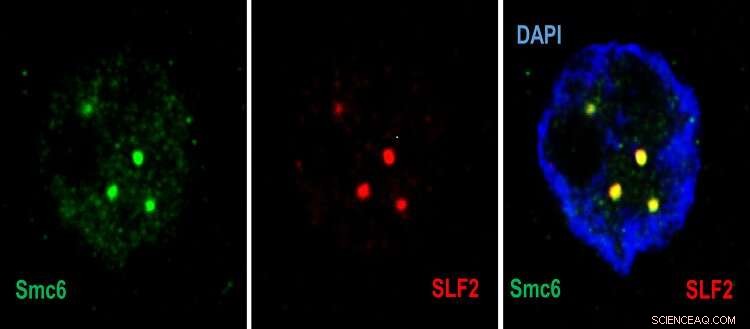
Confocale microscopiebeelden die in de celkern (blauw) worden getoond, de rekrutering van Smc5/6 (groen) door SLF2 (rood) in PML-lichamen. Credit:© UNIGE–Laboratorium van professor Michel Strubin–Regulatie van genexpressie van het hepatitis B-virus–Departement Microbiologie en Moleculaire Geneeskunde.
Het hepatitis B-virus (HBV) is verantwoordelijk voor een van de ernstigste en meest voorkomende infectieziekten. Het wordt overgedragen via biologische vloeistoffen en valt de levercellen aan. De chronische vorm van de ziekte kan leiden tot ernstige complicaties, waaronder cirrose en leverkanker. Er is geen effectieve behandeling voor de chronische vorm van de ziekte, die alleen kan worden voorkomen door vaccinatie. Na het identificeren van een belangrijk eiwitcomplex dat actief is wanneer ons lichaam wordt geïnfecteerd door het virus, heeft een team van de Universiteit van Genève (UNIGE) de precieze werking van dit beschermende mechanisme ontcijferd, waardoor de weg vrij is voor nieuwe therapeutische doelen. Deze resultaten zijn te lezen in het tijdschrift Nature Structural &Molecular Biology .
Hepatitis B is de meest voorkomende vorm van hepatitis. Het is een virale ziekte die wordt veroorzaakt door het hepatitis B-virus. Het wordt voornamelijk seksueel overdraagbaar of overgedragen via bloed. Het is tot 100 keer besmettelijker dan hiv. Door de levercellen te infecteren, veroorzaakt dit virus een voorbijgaande ontsteking van dit orgaan die ook kan evolueren naar een chronische infectie. Dit kan vervolgens leiden tot ernstige pathologieën, zoals cirrose of leverkanker. Naar schatting overlijden wereldwijd jaarlijks bijna 1 miljoen mensen aan deze ziekte. Er is geen definitieve behandeling voor chronische hepatitis B. De enige manier om het te voorkomen is om te worden gevaccineerd voordat de ziekte optreedt.
In 2016 onthulde een UNIGE-team onder leiding van Michel Strubin, universitair hoofddocent bij de afdeling Microbiologie en Moleculaire Geneeskunde en in het Geneefse Centrum voor Inflammatieonderzoek aan de UNIGE Faculteit Geneeskunde, een mechanisme dat cruciaal is voor het begrijpen van deze ziekte:wanneer onze immuunsysteem verdedigt zich ertegen, een complex - een onderling afhankelijke set - van zes eiwitten genaamd SMC5/6, aanwezig in onze cellen, detecteert het virale DNA en blokkeert het. Het virus slaat dan terug en produceert een specifiek eiwit, het X-eiwit. Dit eiwit komt de cel binnen en breekt SMC5/6 af, dat zijn schildwachtrol niet meer kan spelen.
Een mechanisme in drie stappen
Vóór deze ontdekking was de antivirale functie van SMC5/6 onbekend. Het werd alleen geïdentificeerd als een sleutelcomplex voor het structurele onderhoud van onze chromosomen. Vandaag heeft het team van Michel Strubin een nieuwe doorbraak bereikt. In een recente studie, uitgevoerd in samenwerking met het Amerikaanse farmaceutische bedrijf Gilead Sciences, identificeerden de UNIGE-onderzoekers de drie stappen en de specifieke eiwitten die nodig zijn voor SMC5/6 om zijn antivirale rol te spelen.
"In de eerste stap detecteert een eiwit van het SMC5/6-complex het DNA van het virus en vangt het op", legt Fabien Abdul uit, een senior onderzoeks- en onderwijsassistent bij de afdeling Microbiologie en Moleculaire Geneeskunde van de UNIGE-faculteit Geneeskunde en eerste auteur van de studie. "Dan neemt een tweede eiwit van het complex - SLF2 - het gevangen DNA van het virus mee naar een subcompartiment van de kern van de aangevallen cel, het PML-lichaam genoemd. Een derde eiwit - Nse2 - komt dan in het spel en remt de virus'-chromosoom."
Omdat SMC een grote familie van eiwitcomplexen is, wilden de onderzoekers ook weten of andere leden van deze familie aan hepatitis B-viraal DNA konden binden. "We ontdekten dat deze competentie uniek was voor SMC5/6", zegt Fabien Abdul.
Naar nieuwe therapeutische doelen
Om deze resultaten te bereiken, werkte het onderzoeksteam aan in vitro celculturen. "We used molecular biology techniques and more specifically genetic scissors called CRISPR-Cas9. This tool allowed us to cut the DNA strands within the cells and thus delete or modify the gene coding for each protein constituting the SMC5/6 complex. Thanks to this technique, we were able to make one or other of the proteins disappear and thus understand their respective functions within the complex," explains Michel Strubin, the study's last author. Based on these observations, the three steps of the antiviral mechanism could be established.
This discovery provides a better understanding of how the complex functions during its antiviral action. It could thus pave the way for the identification of new therapeutic targets to combat the hepatitis B virus. "The next stage of research will consist of better deciphering the mechanism of inhibition of the virus in the sub-compartment of the cell nucleus," indicates Aurélie Diman, a postdoctoral researcher in Michel Strubin's laboratory. Work will also have to be carried out on the X protein, whose role was identified by the UNIGE researchers in 2016, in order to better understand the counter-attack mechanism of hepatitis B against the antiviral activity of the cellular SMC5/6. + Verder verkennen
Counterattack of the hepatitis B virus
 De baanbrekende techniek van scheikundigen in Miami maakt ontwerpen mogelijk op het grensvlak van scheikunde en biologie
De baanbrekende techniek van scheikundigen in Miami maakt ontwerpen mogelijk op het grensvlak van scheikunde en biologie Operatie in een pil een mogelijke behandeling voor diabetes
Operatie in een pil een mogelijke behandeling voor diabetes Het bereiken van 90% PL-kwantumopbrengst in 1-D metaalhalogenide door drukonderdrukt niet-stralingsverlies
Het bereiken van 90% PL-kwantumopbrengst in 1-D metaalhalogenide door drukonderdrukt niet-stralingsverlies Hoe entropieverandering te berekenen
Hoe entropieverandering te berekenen  Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie
Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie
 Verlaten boten van glasvezel laten overal ter wereld gifstoffen en microplastics vrij
Verlaten boten van glasvezel laten overal ter wereld gifstoffen en microplastics vrij Hoe vulkanen op aarde een venster bieden op de evolutie van het leven en het zonnestelsel
Hoe vulkanen op aarde een venster bieden op de evolutie van het leven en het zonnestelsel Duitse boeren klagen regering aan wegens gemiste klimaatdoelen
Duitse boeren klagen regering aan wegens gemiste klimaatdoelen De meeste EU-landen missen luchtkwaliteitsdoelen:rapport
De meeste EU-landen missen luchtkwaliteitsdoelen:rapport Conflict en droogte verwoesten de gewaardeerde dadelpalmen van Irak
Conflict en droogte verwoesten de gewaardeerde dadelpalmen van Irak
Hoofdlijnen
- Hoeveel (DNA) schade kan een kankercel verdragen?
- Ja,
- Het bacteriële sociale netwerk hacken
- Is geluk besmettelijk?
- Groter en levensechter:wat is de toekomst van bioprinted organen?
- Video:studenten insectenbiologie leren kunst van op insecten gebaseerde kleurstoffen
- Mimetolieten:de gezichten die we zien in rotsformaties
- Hoe de botten in het menselijk skelet te bestuderen
- Onderzoekers brengen druggable genomische doelwitten in kaart in evoluerende malariaparasieten
- Tunesische hangende tuinboerderijen houden stand ondanks droogte

- Het behoud van Jaguar hangt af van de houding van de buren

- Zwaarste beenvissen ter wereld geïdentificeerd en correct benoemd

- Een nieuw venster op planten uit het verleden

- Griezelige bescherming:bedreigde diersoorten redden boven onze dode lichamen

 We hebben eindelijk het rulebook voor de Overeenkomst van Parijs, maar wereldwijde klimaatactie is nog steeds ontoereikend
We hebben eindelijk het rulebook voor de Overeenkomst van Parijs, maar wereldwijde klimaatactie is nog steeds ontoereikend Gerestaureerd gladiatorgebouw uit Pompeii open voor publiek
Gerestaureerd gladiatorgebouw uit Pompeii open voor publiek Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden
Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden Add-on clip maakt van smartphone een volledig operationele microscoop
Add-on clip maakt van smartphone een volledig operationele microscoop Een mogelijke verklaring voor hoe kiemlijnen worden verjongd
Een mogelijke verklaring voor hoe kiemlijnen worden verjongd Nieuwe kreukelmethode brengt plat grafeen van 2D naar 3D
Nieuwe kreukelmethode brengt plat grafeen van 2D naar 3D Van super- tot ultraresolutiemicroscopie:nieuwe methode verlegt de grenzen in beeldresolutie
Van super- tot ultraresolutiemicroscopie:nieuwe methode verlegt de grenzen in beeldresolutie Alle systemen gaan in Houston terwijl NASA de terugkeer naar de maan voorbereidt
Alle systemen gaan in Houston terwijl NASA de terugkeer naar de maan voorbereidt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

