
Wetenschap
Kipferl:begeleiding van de verdediging tegen springgenen
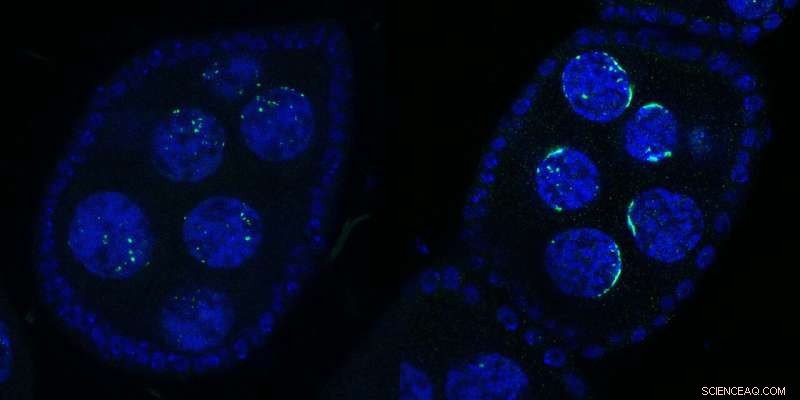
Twee eierkamers van Drosophila met verschillende kernen:Wild Type (links) of bij Kipferl-inactivatie (rechts). Het DNA wordt weergegeven in blauw en Rhino in groen. Na mutatie of verwijdering van het partnereiwit Kipferl (rechts), verliest Rhino zijn affiniteit voor de piRNA-clustersequenties over het genoom (groene stippen in het linkerpaneel) maar wordt gesekwestreerd door de pericentromere satellietarrays (groene halvemaanachtige vormen aan de rechterkant paneel). De halvemaanvormen inspireerden de naam "Kipferl", de naam van een Oostenrijks gebak. Krediet:Baumgartner/Brennecke/IMBA
Een groot deel van ons DNA bestaat uit egoïstische repetitieve DNA-elementen, waarvan sommige van de ene plaats in het genoom naar de andere kunnen springen en mogelijk het genoom kunnen beschadigen. Onderzoekers van het Instituut voor Moleculaire Biotechnologie van de Oostenrijkse Academie van Wetenschappen (IMBA) beschrijven hoe verschillende soorten repetitieve DNA-elementen worden gecontroleerd door hetzelfde silencing-mechanisme in de eierstokken van fruitvliegen.
Centraal in hun bevindingen staat een niet-gekarakteriseerd eiwit dat de onderzoekers "Kipferl" noemden, dat zorgt voor de effectieve controle van springgenen. De bevindingen suggereren dat verschillende egoïstische elementen strijden om het afweersysteem van het genoom van de gastheer en dat Kipferl misschien de eerste is van een reeks gelijkaardig werkende moleculen die nog moeten worden ontdekt. De bevindingen zijn gepubliceerd in eLife .
Ongeveer de helft van het menselijk genoom, en een vijfde van het fruitvlieggenoom, bestaat uit genetische parasieten die lijken op genen die kopieën van zichzelf kunnen maken en zichzelf kunnen invoegen in willekeurige delen van ons genoom, waardoor de normale genexpressie mogelijk wordt verstoord. Er zijn meerdere verdedigingsmechanismen ontwikkeld om deze zogenaamde transposons onder controle te houden.
Een zo'n mechanisme is een RNA-interferentiesysteem dat de piRNA-route wordt genoemd. De piRNA-route is een kleine RNA-uitschakelingsroute die in het hele dierenrijk wordt geconserveerd, van sponzen tot zoogdieren. Dit silencing-mechanisme maakt gebruik van piRNA's die zijn gegenereerd uit transposon-rijke sequenties in het DNA die 'piRNA-clusters' worden genoemd.
piRNA's zijn kleine RNA's die koppelen met zogenaamde Argonaute-eiwitten van de silencing-machinerie om de transposons te richten die complementair zijn aan hun sequentie. Daarom dienen deze piRNA's als blauwdrukken om transposons met complementaire sequenties in het genoom te identificeren en tot zwijgen te brengen, ongeacht hoe ver ze konden springen.
De fruitvlieg Drosophila melanogaster, waarin de piRNA-route voor het eerst werd geïdentificeerd, gebruikt een eiwit genaamd "Rhino" om piRNA-clusters in het genoom te vinden. Hoe Rhino de piRNA-clusters in het DNA herkent, bleef echter onbekend.
"Eerdere in vitro-gegevens hadden een affiniteit van Rhino aangetoond voor een specifiek epigenetisch kenmerk, de chromatine-modificatie H3K9me3", zegt IMBA-groepsleider Julius Brennecke, de corresponderende auteur van het onderzoek. Deze modificatie is een marker van "heterochromatine", een vorm van dicht opeengepakt DNA waarin genen tot zwijgen worden gebracht.
H3K9me3 is echter niet specifiek voor piRNA-clusters, maar wordt ook vaak aangetroffen in andere dicht opeengepakte regio's van het genoom. Daar wordt H3K9me3 gebonden door het belangrijkste heterochromatine-eiwit 1 (HP1), een naaste verwant van Rhino.
Waarom HP1 en Rhino binden aan verschillende subsets van heterochromatine, hoewel ze allebei een vergelijkbare affiniteit hebben voor dezelfde chromatinemodificatie, was lang onduidelijk. "Zonder enige twijfel was H3K9me3 vereist, maar niet voldoende om de binding van Rhino aan chromatine te verklaren. Daarom wisten we dat er extra moleculaire signalen moesten zijn die Rhino helpen richten op piRNA-clusters," voegt Brennecke toe.
In de zoektocht naar deze moleculaire cue catalogiseerde het team directe interactoren van Rhino, op zoek naar een partnereiwit dat Rhino mogelijk naar piRNA-clusters zou kunnen leiden. Met behulp van een combinatie van genetische, genomische en beeldvormende benaderingen, identificeerden de onderzoekers Rhino's "metgezel" in de eierstokken van Drosophila:een eiwit dat verschillende zinkvingerplooien bevat die ze "Kipferl" noemden.
Kipferl bindt niet alleen aan neushoorn, maar gebruikt ook zijn zinkvingers voor de sequentiespecifieke binding aan guanosinerijke DNA-motieven. Het team ontdekte dat de meeste piRNA-clusters worden gedefinieerd door de combinatie van Kipferl's specifieke DNA-bindingsplaatsen met lokaal heterochromatine. Op deze plaatsen wordt de interactie van Rhino met H3K9me3-epigenetische markeringen gestabiliseerd door Kipferl, wat verklaart waarom Rhino zich slechts aan een klein deel van al het heterochromatine in het genoom bindt.
Om een niveau van complexiteit toe te voegen, wist het team dat Rhino niet alleen lokaliseert naar piRNA-clusters. Onlangs was aangetoond dat neushoorn zich bindt aan zogenaamde 'satelliet-arrays'. Dit zijn repetitieve sequenties van niet-coderend en niet-transponerend DNA dat zich dicht bij de centromeren van de chromosomen bevindt.
"We zagen een opvallend effect op neushoorn toen we vliegen genereerden met gemuteerde of afwezige Kipferl en ze onder de microscoop bekeken", zegt eerste auteur Lisa Baumgartner, een promovendus in het Brennecke-lab van IMBA. Toen Kipferl werd gemuteerd, was Rhino niet langer gelokaliseerd in de piRNA-clusters over het genoom. In plaats daarvan accumuleerde het sterk op genomische satellietarrays.
"In plaats van kleinere stippen die rond de kern waren verdeeld, zagen we neushoorns verschillende halvemaanachtige vormen vormen. Op basis van deze allereerste waarneming noemden we het nieuwe eiwit 'Kipferl', naar een populair Oostenrijks gebak in de vorm van een croissant. We ontdekten alleen veel later dat deze structuren overeenkwamen met Mega-base stukken satellietarrays." Daarom toonden de wetenschappers aan dat Kipferl hielp om Rhino correct te distribueren naar piRNA-clusters en zijn sekwestratie naar satellietarrays te voorkomen.
Neushoorn is een van de snelst evoluerende eiwitten in het vliegengenoom. Brennecke en zijn team veronderstellen dat deze snelle evolutie mogelijk te wijten is aan positieve evolutionaire druk vanuit de satellietarrays.
"De satellietarrays transponeren niet, maar kunnen recombineren. Als ze dit echter op een ongecontroleerde manier doen, kunnen hele chromosoomarmen verloren gaan. Daarom hebben de satellietarrays mogelijk een controlemechanisme nodig waarbij Rhino en andere piRNA-pathway-componenten betrokken zijn om ze te helpen verpakken in strak heterochromatine. Dit zou de reden kunnen zijn waarom de satellietarrays alle neushoorns die ze konden vinden lijken te willen afzonderen", legt Baumgartner uit.
Baumgartner denkt dat neushoorn en de piRNA-route een heel verschillende rol kunnen spelen in hun interacties met de satellietarrays of de piRNA-clusters en transposons. "Het springen en vermenigvuldigen van transposons vormt een gevaar voor de functionaliteit van het genoom, waardoor het noodzakelijk is dat het piRNA-pad ze tot zwijgen brengt", zegt ze.
"Daarom is in de ogen van transposons de piRNA-route de 'vijand' die voorkomt dat ze zich door het genoom verspreiden. Satelliet-arrays hebben daarentegen gewoon een extra controlelaag nodig om ervoor te zorgen dat ze hun hoge kopie kunnen behouden aantal zonder het genoom te beschadigen door ongewenste recombinatie. Daarom zou ik, in de ogen van de satellietarrays, denken dat Rhino een factor is die hun overleving garandeert", legt ze uit.
Op basis van deze observaties en analyses suggereren de wetenschappers dat de satellietarrays mogelijk een ander partnereiwit zoals Kipferl gebruiken om Rhino te lokaliseren in hun DNA.
"Om de sekwestratie van Rhino door de satellietarrays tegen te gaan, speculeren we dat Kipferl mogelijk is geëvolueerd uit een noodzaak om Rhino te helpen retargetten naar de piRNA-clusters. Daarom suggereren onze bevindingen dat Rhino mogelijk gevangen zit in een kruisvuur van genetische conflicten." zegt Brennecke. Bovendien komt Rhino zowel in de testikels als in de eierstokken van de fruitvlieg tot uiting, terwijl Kipferl alleen in de eierstokken tot uiting komt. "Kipferl is misschien wel de eerste van een aantal Rhino-begeleidingsfactoren die nog moeten worden ontdekt", concludeert Brennecke. + Verder verkennen
Hoe cellen hun eigen genen hacken
 Wat is het verschil tussen reactanten en producten in een chemische reactie?
Wat is het verschil tussen reactanten en producten in een chemische reactie?  Soorten geleidbaarheid
Soorten geleidbaarheid  Experimenten over verdamping en oppervlakte
Experimenten over verdamping en oppervlakte  Hoe RNA werd gevormd bij de oorsprong van het leven
Hoe RNA werd gevormd bij de oorsprong van het leven Meer MXene maken:onderzoekers onthullen een schaalbaar productiesysteem voor de veelbelovende, 2-D nanomaterialen
Meer MXene maken:onderzoekers onthullen een schaalbaar productiesysteem voor de veelbelovende, 2-D nanomaterialen
Hoofdlijnen
- eDNA gebruiken om de broedhabitat van bedreigde diersoorten te identificeren
- Onderzoekers identificeren hoe bacterie overleeft in zuurstofarme omgevingen
- Ideeën voor het maken van een 3-D DNA-standaard voor middelbare school
- Community (ecologie): definitie, structuur, theorie en voorbeelden
- Nieuw onderzoek toont aan dat dinosaurusmest de planeet bevrucht
- Wat is de functie van een eicel?
- Hoe succesvol te zijn in de microbiologie
- Onderzoek naar maïsgenetica onthult het mechanisme achter het stil worden van eigenschappen
- 25 soorten onthuld voor 25 Genomes Project
- Onderzoek naar maïsgenetica onthult het mechanisme achter het stil worden van eigenschappen

- Interspecifieke concurrentie versus intraspecifieke concurrentie

- Honden in de winter beschermen tegen extreme kou, ijs, zout en deicers

- Onderzoekers modelleren voordelen van bosherstel aan rivieroevers

- Dichte vloeistofdruppels fungeren als mobiele computers

 Onderzoekers ontwerpen nepsterrenstelsels en meer om zich voor te bereiden op een instrument voor het in kaart brengen van de lucht
Onderzoekers ontwerpen nepsterrenstelsels en meer om zich voor te bereiden op een instrument voor het in kaart brengen van de lucht Onderzoekers identificeren afweermechanisme van malariaparasiet
Onderzoekers identificeren afweermechanisme van malariaparasiet Elektronisch afval wordt gewonnen voor zeldzame aardelementen
Elektronisch afval wordt gewonnen voor zeldzame aardelementen Wetenschappers beschrijven het meest complete fossiel uit de vroege stadia van de evolutie van de uil
Wetenschappers beschrijven het meest complete fossiel uit de vroege stadia van de evolutie van de uil Moleculaire zuurstof gedetecteerd in de dichtstbijzijnde quasar
Moleculaire zuurstof gedetecteerd in de dichtstbijzijnde quasar Waspluisjes kunnen aanzienlijke weefselschade veroorzaken in zeemosselen
Waspluisjes kunnen aanzienlijke weefselschade veroorzaken in zeemosselen Unieke nanocapsules beloven de gerichte medicijnafgifte
Unieke nanocapsules beloven de gerichte medicijnafgifte Prolific Mars Reconnaissance Orbiter voltooit 50, 000 banen
Prolific Mars Reconnaissance Orbiter voltooit 50, 000 banen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

