
Wetenschap
Onderzoekers identificeren hoe bacterie overleeft in zuurstofarme omgevingen

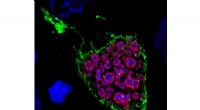
Biofilms zijn meercellige gemeenschappen gevormd door dicht opeengepakte microben die vaak worden geassocieerd met aanhoudende infecties. In deze overvolle structuren vormen zich steile gradiënten van voedingsstoffen en zuurstof. De menselijke ziekteverwekker Pseudomonas aeruginosa produceert moleculen, fenazines genaamd, die hem helpen om te gaan met de zuurstofbeperkte omstandigheden in biofilms. Columbia-onderzoekers hebben nieuwe rollen ontdekt voor eiwitten van de elektronentransportketen die hen betrekken bij het gebruik van fenazinen. Krediet:Nicoletta Barolini, Universiteit van Columbia
Biologen van Columbia University hebben een mechanisme onthuld waarmee bacteriële cellen in overvolle, zuurstofarme omgevingen hebben toegang tot zuurstof voor energieproductie, overleving van de cel te verzekeren. De bevinding zou kunnen verklaren hoe sommige bacteriën, zoals Pseudomonas aeruginosa ( P. aeruginosa ), kunnen gedijen in zuurstofarme omgevingen zoals biofilms en zijn bestand tegen antibiotica.
" P. aeruginosa biofilminfecties zijn een belangrijke doodsoorzaak voor mensen die lijden aan cystische fibrose, een genetische aandoening die de longen en het spijsverteringsstelsel aantast, " zei hoofdonderzoeker Lars Dietrich, een universitair hoofddocent biologische wetenschappen. "Begrip van de paden die bijdragen aan het voortbestaan en de virulentie van P. aeruginosa en andere bacteriën die in zuurstofarme omgevingen kunnen bestaan, zouden de behandelmethoden voor veel van deze en andere immuungecompromitteerde patiënten kunnen informeren."
Het onderzoek verschijnt deze week in het tijdschrift eLife .
Bacteriën leven zelden op zichzelf als eencellige organismen. De meeste groeien in plaats daarvan in gemeenschappen, gebruik maken van de kracht van getallen om een biofilm te vormen met weefselachtige eigenschappen vergelijkbaar met een steiger die dient om de gemeenschap te versterken, opmaken tot 1, 000 keer resistenter tegen de meeste antibiotica.
Elke individuele cel moet op zijn eigen elektronen uit voedsel halen die vervolgens langs het celmembraan worden getransporteerd totdat ze een zuurstofmolecuul bereiken. De energie die vrijkomt tijdens dit metabolische proces wordt gebruikt om het leven in stand te houden. Terwijl gemeenschappen van bacteriën blijven groeien en zich vormen tot een biofilm, echter, ze kunnen overvol raken, het creëren van een omgeving waarin elke cel moet strijden om beperkte voedingsstoffen en zuurstof om te overleven.
Onderzoek heeft aangetoond dat sommige bacteriën, inclusief P. aeruginosa , hebben verschillende strategieën ontwikkeld om te reageren op en het hoofd te bieden aan de zuurstofarme omstandigheden in biofilms. Gemeenschappen van bacteriën kunnen, bijvoorbeeld, verander de algehele structuur van de biofilm zodat de oppervlakte-tot-volumeverhouding hoger is en een groter deel van de cellen binnenin toegang heeft tot de zuurstof aan de buitenkant. P. aeruginosa kan ook moleculen maken die fenazines worden genoemd, die helpen om elektronen van binnen naar buiten de cel te transporteren en uiteindelijk naar zuurstof die op afstand beschikbaar is. Een andere strategie is om alternatieve versies van terminale oxidasen te maken, enzymen in het membraan die elektronen overdragen aan zuurstof, die zuurstof efficiënter gebruiken of beter zijn in het wegvangen van zuurstof wanneer de concentratie ervan laag is. Hoewel er talloze onderzoeken zijn gedaan om het belang van deze enzymen en strategieën voor P. aeruginosa groei, ze zijn grotendeels uitgevoerd in goed geoxygeneerde vloeibare culturen in het laboratorium. Wanneer P. aeruginosa een echte gastheer infecteert, zoals een mens, het groeit vaak als een biofilm en ontmoet enorm verschillende omstandigheden.
Met federale financiering van de National Institutes of Health en de National Science Foundation, Dietrich, eerste auteur Jeanyoung Jo, en hun collega's wilden beter begrijpen of specifieke terminale oxidasen belangrijk zijn voor P. aeruginosa metabolisme in biofilmgemeenschappen, hoe fenazines lage zuurstofniveaus kunnen compenseren, en hoe deze aangepaste strategieën kunnen bijdragen aan: P. aeruginosa het vermogen om infecties te veroorzaken.
Ze ontdekten dat de elektronentransportketen die zo cruciaal is voor de omzetting van elektronen in energie, diep in de zuurstofarme biofilm kan en werkt, en dat in deze omgevingen, de bacterie is afhankelijk van een specifiek deel van het terminale oxidase van de keten - een eiwit dat CcoN4 wordt genoemd - om toegang te krijgen tot zuurstof en normaal te groeien. Cellen die dit eiwit missen, overleven niet zo goed als cellen ermee en daarom denken de onderzoekers dat CcoN4 bijdraagt aan de virulentie van de bacterie. Ze ontdekten ook dat CcoN4 een rol speelt bij het optimaal gebruiken van fenazines in biofilms. Hoewel eerder is aangetoond dat deze fenazinen metabolisch compenseren voor de zuurstofarme omstandigheden in P. aeruginosa biofilms, het mechanisme dat dit mogelijk maakte, was een wetenschappelijk mysterie gebleven.
"Deze bacterie is een meester in het vinden van verschillende strategieën om toegang te krijgen tot zuurstof, Dietrich zei. "We wisten dat er fenazines bij betrokken waren en dat ze de cel op de een of andere manier hielpen om zuurstof te krijgen. maar we wisten niet hoe. Het lijkt erop dat ze afkomstig zijn van de elektronentransportketen. Dat is een belangrijke openbaring. We weten dat bacteriële cellen verschillende manieren hebben om energie te metaboliseren in zuurstofrijke omgevingen, maar voor de langste tijd konden we niet achterhalen hoe ze het deden als zuurstof moeilijk toegankelijk is."
De bevindingen kunnen grote implicaties hebben voor de behandeling van P. aeruginosa biofilm infecties, als een begrip van de paden die bijdragen aan P. aeruginosa overleving en virulentie zouden de behandelmethoden voor patiënten kunnen informeren. Het ontwikkelen van therapieën die CcoN4-bevattende terminale oxidasen blokkeren, bijvoorbeeld, zou de bacterie en zijn vermogen om infecties te veroorzaken verzwakken.
"We beginnen steeds meer te begrijpen hoe cellen kunnen overleven in behoorlijk afschuwelijke omstandigheden, ' zei Dietrich. 'We begrijpen het mechanisme. Nu kunnen we gaan zoeken naar manieren om dat proces te stoppen."
 Nieuwe meettechniek kan pulpfabrieken miljoenen besparen
Nieuwe meettechniek kan pulpfabrieken miljoenen besparen Uitvinding van 's werelds sterkste zilver
Uitvinding van 's werelds sterkste zilver Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders
Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders Onderzoekers ontdekken een verband tussen twee belangrijke producten van stikstofmonoxide
Onderzoekers ontdekken een verband tussen twee belangrijke producten van stikstofmonoxide Hightech printen kan helpen om pijnlijke schoten te voorkomen
Hightech printen kan helpen om pijnlijke schoten te voorkomen
 Jakobshavn-gletsjer groeit voor derde jaar op rij
Jakobshavn-gletsjer groeit voor derde jaar op rij Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek
Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek Waarom de Middellandse Zee een hotspot voor klimaatverandering is
Waarom de Middellandse Zee een hotspot voor klimaatverandering is Gezondheidsrisicoalarm over waterrantsoenering in Rome
Gezondheidsrisicoalarm over waterrantsoenering in Rome Duurzaamheid van het voedselsysteem vereist een lager energieverbruik
Duurzaamheid van het voedselsysteem vereist een lager energieverbruik
Hoofdlijnen
- Waar voedsel beperkt is, guppy-moeders dragen hun jongen langer
- Hoe een TAPPI-kaart te gebruiken
- Stropers richten zich op Afrikaanse leeuwen, gieren met vergif
- Vijf soorten genverbindingsmechanismen
- De effecten van ultraviolette straling op gist
- Van Zuidoost-Azië tot de riolen:studie bepaalt nieuwe geografische oorsprong van bruine ratten
- Hoe uw dieet het dierenwelzijn kan verbeteren
- Stappen voor het traceren van een plant:zaadverspreiding volgen met behulp van chloroplast-DNA
- Hoe groeit schimmel op voedsel?
- Zijn linkshandigen snellere denkers dan rechtshandigen?

- Zenuwen controleren de bacteriële gemeenschap van het lichaam

- Onderzoekers identificeren afweermechanisme van malariaparasiet
- Hoge prijzen van dierlijke producten onderdeel van een vicieuze cirkel naar uitsterven

- Het vreemde geval van de duikvlieg

 Bosbranden, barbecueverboden:hittegolf verschroeit Europa
Bosbranden, barbecueverboden:hittegolf verschroeit Europa Hoe continenten werden gerecycled
Hoe continenten werden gerecycled Onbreekbaar glas geïnspireerd op schelpen
Onbreekbaar glas geïnspireerd op schelpen Onderzoekers gebruiken fysica van luchtstromen om gaslekken sneller te lokaliseren in complexe scenario's
Onderzoekers gebruiken fysica van luchtstromen om gaslekken sneller te lokaliseren in complexe scenario's Hoe de bèta te vinden met een alfahypothese
Hoe de bèta te vinden met een alfahypothese  Hoe werken aneroïde barometers?
Hoe werken aneroïde barometers?  Bloedzuigende insecten en insecten
Bloedzuigende insecten en insecten Catalyst Advance verbetert de technologie voor het reinigen van aardgas
Catalyst Advance verbetert de technologie voor het reinigen van aardgas
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

