
Wetenschap
Wetenschappers passen CRISPR aan om diabetes epigenetisch te behandelen, nierziekte, spierdystrofie
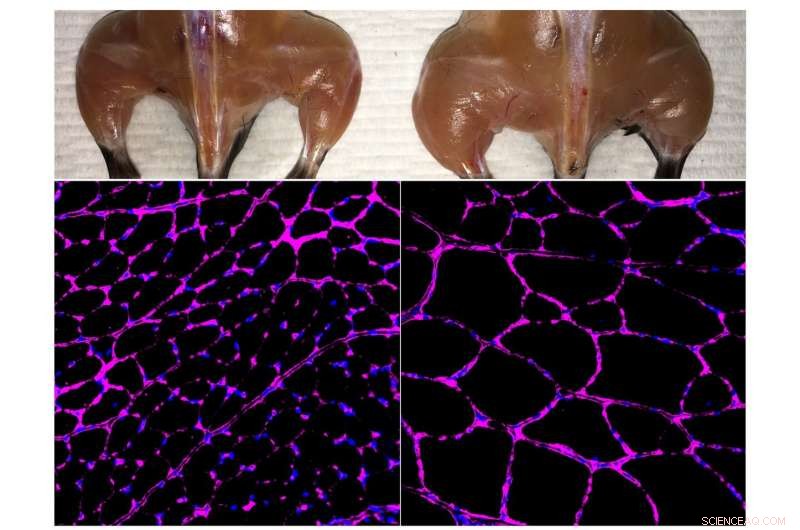
Het geavanceerde in vivo Cas9-gebaseerde epigenetische genactiveringssysteem van het Belmonte-lab verbetert de skeletspiermassa (boven) en de groei van de vezelgrootte (onder) in een behandelde muis (rechts) in vergelijking met een onafhankelijke controle (links). De fluorescentiemicroscopiebeelden onderaan tonen paarse kleuring van het laminine-glycoproteïne in tibialis anterior spiervezels. Krediet:Salk Institute
Salk-wetenschappers hebben een nieuwe versie gemaakt van de CRISPR/Cas9-technologie voor het bewerken van het genoom waarmee ze genen kunnen activeren zonder breuken in het DNA te veroorzaken. mogelijk het omzeilen van een grote hindernis voor het gebruik van technologieën voor het bewerken van genen om menselijke ziekten te behandelen.
De meeste CRISPR/Cas9-systemen werken door het creëren van "double-strand breaks" (DSB's) in regio's van het genoom die bedoeld zijn voor bewerking of verwijdering, maar veel onderzoekers zijn tegen het creëren van dergelijke breuken in het DNA van levende mensen. Als proof-of-concept, de Salk-groep gebruikte hun nieuwe aanpak om verschillende ziekten te behandelen, inclusief suikerziekte, acute nierziekte, en spierdystrofie, in muismodellen.
"Hoewel veel studies hebben aangetoond dat CRISPR/Cas9 kan worden toegepast als een krachtig hulpmiddel voor gentherapie, er zijn groeiende zorgen over ongewenste mutaties die worden gegenereerd door de dubbelstrengige breuken door deze technologie, " zegt Juan Carlos Izpisua Belmonte, een professor in Salk's Gene Expression Laboratory en senior auteur van het nieuwe artikel, gepubliceerd in Cel op 7 dec. 2017. "We hebben die zorg kunnen omzeilen."
In het originele CRISPR/Cas9-systeem, het enzym Cas9 is gekoppeld aan gids-RNA's die het op de juiste plek in het genoom richten om DSB's te creëren. Onlangs, sommige onderzoekers zijn begonnen met het gebruik van een "dode" vorm van Cas9 (dCas9), die zich nog op specifieke plaatsen in het genoom kunnen richten, maar knipt niet langer DNA. In plaats daarvan, dCas9 is gekoppeld aan transcriptionele activeringsdomeinen - moleculaire schakelaars - die gerichte genen inschakelen. Maar het resulterende eiwit - dCas9 dat aan de activatorschakelaars is bevestigd - is te groot en omvangrijk om in het voertuig te passen dat doorgaans wordt gebruikt om dit soort therapieën aan cellen in levende organismen te leveren. namelijk adeno-geassocieerde virussen (AAV's). Het ontbreken van een efficiënt toedieningssysteem maakt het erg moeilijk om deze tool in klinische toepassingen te gebruiken.
Het team van Izpisua Belmonte combineerde Cas9/dCas9 met een reeks verschillende activatorschakelaars om een combinatie te ontdekken die werkte, zelfs als de eiwitten niet aan elkaar waren gefuseerd. Met andere woorden, Cas9 of dCas9 was verpakt in één AAV, en de schakelaars en gids-RNA's werden in een andere verpakt. Ze optimaliseerden ook de gids-RNA's om ervoor te zorgen dat alle stukjes op de gewenste plaats in het genoom terechtkwamen, en dat het beoogde gen sterk geactiveerd was.
"De componenten werken allemaal samen in het organisme om endogene genen te beïnvloeden, " zegt Hsin-Kai (Ken) Liao, een stafonderzoeker in het Izpisua Belmonte-lab en co-eerste auteur van het nieuwe artikel. Op deze manier, de technologie werkt epigenetisch, wat betekent dat het de genactiviteit beïnvloedt zonder de DNA-sequentie te veranderen.
Om de methode te testen, de onderzoekers gebruikten muismodellen van acuut nierletsel, type 1 diabetes en een vorm van spierdystrofie. In ieder geval, ze ontwikkelden hun CRISPR/Cas9-systeem om de expressie van een endogeen gen te stimuleren dat mogelijk ziektesymptomen zou kunnen omkeren. In het geval van een nierziekte, ze activeerden twee genen waarvan bekend is dat ze betrokken zijn bij de nierfunctie, en observeerde niet alleen verhoogde niveaus van de eiwitten die met die genen zijn geassocieerd, maar verbeterde nierfunctie na een acuut letsel. Voor type 1-diabetes, ze waren gericht op het stimuleren van de activiteit van genen die insulineproducerende cellen zouden kunnen genereren. Alweer, de behandeling werkte, het verlagen van de bloedsuikerspiegel in een muismodel van diabetes. Voor spierdystrofie, de onderzoekers brachten genen tot expressie waarvan eerder is aangetoond dat ze ziektesymptomen omkeren, waaronder één bijzonder groot gen dat niet gemakkelijk kan worden afgeleverd via traditionele virus-gemedieerde gentherapieën.
"We waren erg enthousiast toen we de resultaten bij muizen zagen, " voegt Fumiyuki Hatanaka toe, een onderzoeksmedewerker in het laboratorium en co-eerste auteur van het papier. "We kunnen genactivering induceren en tegelijkertijd fysiologische veranderingen zien."
Het team van Izpisua Belmonte werkt nu aan het verbeteren van de specificiteit van hun systeem en het toepassen ervan op meer celtypen en organen om een breder scala aan menselijke ziekten te behandelen, evenals om specifieke organen te verjongen en het verouderingsproces en leeftijdsgerelateerde aandoeningen zoals gehoorverlies en maculaire degeneratie om te keren. Er zullen meer veiligheidstests nodig zijn voor proeven op mensen, ze zeggen.
 Onderzoekers zetten twee stappen richting groene brandstof
Onderzoekers zetten twee stappen richting groene brandstof DNA-origami overtreft belangrijke drempels
DNA-origami overtreft belangrijke drempels Röntgenfoto's laten zien hoe perioden van stress een ijstijdhyena tot op het bot veranderden
Röntgenfoto's laten zien hoe perioden van stress een ijstijdhyena tot op het bot veranderden Uitbreiding van de biosyntheseroute via retrobiosynthese
Uitbreiding van de biosyntheseroute via retrobiosynthese Het verschil tussen isotopen van hetzelfde element
Het verschil tussen isotopen van hetzelfde element
 Nieuwe 3D-beeldtechnologie brengt Schotse koraalriffen in kaart
Nieuwe 3D-beeldtechnologie brengt Schotse koraalriffen in kaart Onderzoek naar de betekenis van oude geometrische grondwerken in het zuidwesten van Amazonië
Onderzoek naar de betekenis van oude geometrische grondwerken in het zuidwesten van Amazonië Heet weer in Griekse hoofdstad legt Akropolis stil
Heet weer in Griekse hoofdstad legt Akropolis stil Loodhoudende benzine is verdwenen – maar loodvervuiling kan nog heel lang aanhouden
Loodhoudende benzine is verdwenen – maar loodvervuiling kan nog heel lang aanhouden Giftige niveaus van arseen in bronwater van het Amazonebekken:studie
Giftige niveaus van arseen in bronwater van het Amazonebekken:studie
Hoofdlijnen
- Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit
- Frankrijk verzet zich tegen EU-verlenging van 5 jaar voor onkruidverdelger glyfosaat
- Getoonde chimpansees die spontaan om de beurt een cijferpuzzel oplossen
- Vijf soorten ecologische relaties
- De structuur en functie van spiercellen
- De adelaars scouten:het bewijs dat het beschermen van nesten de voortplanting bevordert
- Zou het hebben van een eigen kloon hetzelfde zijn als het hebben van een identieke tweeling?
- Wetenschappers ontdekken methode om voedselverspilling om te zetten in biobrandstoffen
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Mieren in het bladerdak van het Amazone-regenwoud hebben veel meer bacteriën in hun ingewanden dan grondbewoners

- Het Mandela-effect:waarom we ons gebeurtenissen herinneren die niet hebben plaatsgevonden

- Waarom het een goed idee is om met je dronken oom over politiek te praten

- Hoe voeden bacteriën?
- Niveaus van celorganisatie

 Hoe meet je geluk?
Hoe meet je geluk?  Kooldioxide afvangen van vrachtwagens en hun uitstoot met 90% verminderen
Kooldioxide afvangen van vrachtwagens en hun uitstoot met 90% verminderen Ambachtelijke brouwerijen verhogen de waarde van woningen
Ambachtelijke brouwerijen verhogen de waarde van woningen Close-up toont binaire protosterren tijdens assemblage
Close-up toont binaire protosterren tijdens assemblage Rapport werpt licht op de impact van effectief schoolleiderschap op de leerresultaten van leerlingen
Rapport werpt licht op de impact van effectief schoolleiderschap op de leerresultaten van leerlingen Italië beboet Ryanair voor massale annulering van vluchten
Italië beboet Ryanair voor massale annulering van vluchten Structuur van primaire optogenetische tool onthuld
Structuur van primaire optogenetische tool onthuld Een kwalitatief model om microscopisch kleine sprongen te beschrijven door plakband af te wikkelen van een rol
Een kwalitatief model om microscopisch kleine sprongen te beschrijven door plakband af te wikkelen van een rol
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

