Wetenschap
Structuur van primaire optogenetische tool onthuld
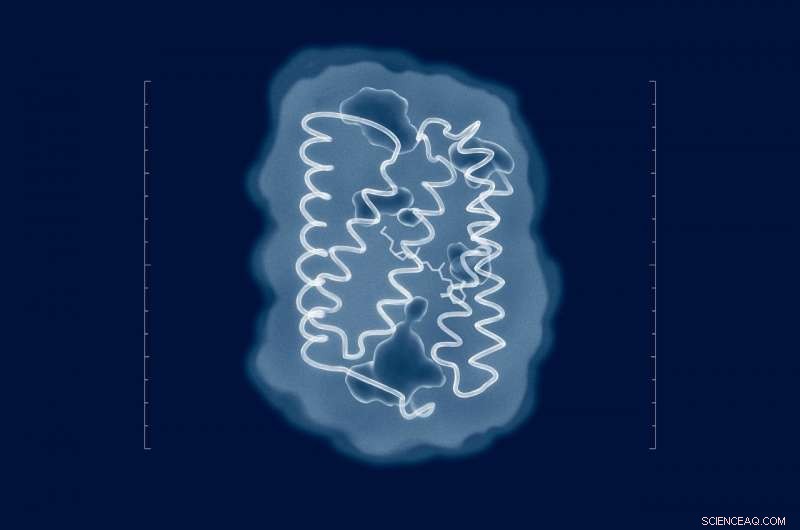
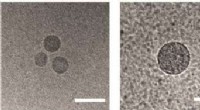
Pogingen om de structuur van ChR2 op te lossen gaan terug tot de tijd van zijn ontdekking in 2003. Maar ondanks de inspanningen van talloze onderzoeksgroepen van over de hele wereld, de structuur van het eiwit in zijn natuurlijke staat is onbekend gebleven. Nu onderzoekers de structuur hebben, zinvolle mutaties kunnen in het eiwit worden geïntroduceerd om de eigenschappen ervan aan te passen aan de vereisten van een specifiek experiment. Krediet:MIPT
Een internationaal team van onderzoekers heeft de 3D-structuur van channelrhodopsin 2 bepaald, een membraaneiwit dat veel wordt gebruikt in de optogenetica om zenuwcellen met licht te controleren. Optogenetica is een relatief nieuwe techniek waarbij licht wordt gebruikt om zenuw- en spiercellen in een levend organisme te manipuleren. Soortgelijke benaderingen worden gebruikt om het verlies van gehoor en gezichtsvermogen gedeeltelijk om te keren en spiercontracties onder controle te houden.
In aanvulling, de methoden van optogenetica worden gebruikt om de eigenschappen van natuurlijke neuronnetwerken te bestuderen, die verantwoordelijk zijn voor emoties, besluitvorming, en andere complexe processen in levende organismen. Optogenetica was Natuur 'Methode van het Jaar 2010, " en wordt ook genoemd onder Wetenschap 's "Doorbraken van 2010 en inzichten van het decennium."
Kanaalrhodopsine 2, of ChR2, is een belangrijk optogenetisch hulpmiddel. Het is een lichtgevoelig eiwit dat oorspronkelijk in 2003 werd gewonnen uit een groene alg genaamd Chlamydomonas reinhardtii. Wetenschappers kunnen ChR2 in het membraan van een levende cel inbrengen om het te controleren. Wanneer verlicht, dit eiwit laat positief geladen ionen via het celmembraan de cel binnen. In een zenuwcel, dit depolariseert het membraan, het effect van een zenuwimpuls nabootsen en ervoor zorgen dat dit specifieke neuron vuren.
Omdat ChR2 snel werkt en relatief onschadelijk is voor cellen, het is de huidige go-to-oplossing voor activering van zenuwcellen. Er is een reeks kunstmatig geïnduceerde mutaties beschikbaar om de eigenschappen van het eiwit te veranderen. Bijvoorbeeld, het is mogelijk om de stroom die het genereert te vergroten of de golflengte van het licht waarop het reageert te veranderen. Dergelijke modificaties stellen onderzoekers in staat om te werken met eiwitten die zijn afgestemd op hun behoeften. Onderzoekers kunnen zelfs verschillende eiwitvarianten combineren voor een duidelijke respons bij verschillende golflengten van licht.
De meeste mutaties die zijn gebruikt om de eigenschappen van ChR2 te wijzigen, zijn tot nu toe min of meer willekeurig geïntroduceerd - hetzij via gerichte evolutie of op basis van de gegevens over bekende eiwitstructuren. De onderzoekers die het dichtst bij een realistische ChR2-structuur zijn gekomen, is een vreemde combinatie die C1C2 wordt genoemd. 70 procent daarvan is gebaseerd op ChR1, een verwant eiwit, met de rest op basis van de werkelijke ChR2. Deze gemengde structuur kan niet alle eigenschappen van het eiwit verklaren. Als resultaat, de mutaties die door dit model worden voorspeld, zijn niet helemaal realistisch en daarom van beperkt belang voor optogenetica.
Om de structuur van ChR2 te onthullen, de auteurs van de studie gebruikten een analytische techniek genaamd röntgendiffractie, die alleen werkt met monsters in de vorm van een kristal. Deze werden door de onderzoekers verkregen via in mesokristallisatie. Het is te zeggen, de eiwitkristallen werden gekweekt in de zogenaamde kubische lipide-mesofase - een medium waardoor eiwitten vrij kunnen bewegen zonder het membraan te verlaten. Om eiwitstructuren te bepalen, hun kristallen werden bestraald met röntgenstralen op een golflengte van ongeveer 1 angstrom, dat is iets minder dan de lengte van de bindingen tussen de atomen in het eiwit. Bij röntgenkristallografie, structuren worden afgeleid door te analyseren hoe straling door een monster wordt verstrooid.
"Pogingen om de structuur van ChR2 op te lossen gaan terug tot de tijd van zijn ontdekking in 2003. Maar ondanks de inspanningen van talloze onderzoeksgroepen van over de hele wereld, de structuur van het eiwit in zijn natuurlijke staat is onbekend gebleven, " zegt Valentin Borsjtsjevski, een van de auteurs van de paper en plaatsvervangend hoofd van het Laboratory for Advanced Studies of Membrane Proteins bij MIPT. "Nu we de structuur hebben, zinvolle mutaties kunnen in het eiwit worden geïntroduceerd om de eigenschappen ervan aan te passen aan de vereisten van een specifiek experiment. De structuur niet kennen, we moesten moeizaam met vallen en opstaan de bruikbare mutaties uitwerken of het doen met de gegevens over verwante eiwitten."
 Grote vulkaanuitbarsting veroorzaakte de grootste massa-extinctie
Grote vulkaanuitbarsting veroorzaakte de grootste massa-extinctie Warmterecords vallen twee keer zo vaak als koude, AP-vondsten
Warmterecords vallen twee keer zo vaak als koude, AP-vondsten Broeikasgaseffect veroorzaakt door conversie van mangrovebossen is behoorlijk significant
Broeikasgaseffect veroorzaakt door conversie van mangrovebossen is behoorlijk significant Verschuiving naar meer intense regens bedreigt historische Italiaanse wijnmakerij
Verschuiving naar meer intense regens bedreigt historische Italiaanse wijnmakerij NASA bestudeert hoe arctische bosbranden de wereld veranderen
NASA bestudeert hoe arctische bosbranden de wereld veranderen
Hoofdlijnen
- Hoe natuurlijke selectie werkt
- Dennen kappen:eerder vroeger dan later doen is beter voor fynbos
- Wat zijn twee kenmerken van mRNA in eukaryoten?
- Europa zet $ 1,18 miljard in om het leven in zee beter te beschermen
- Resultaten van Landmark NASA DNA Twin Study zijn binnen
- Great Basin zaadstudie-experiment richt zich op herstel van weidegronden
- Welke organellen bevinden zich in een prokaryote cel?
- Coole ideeën voor een 3D-model van DNA
- Zijn mensen echt afstammelingen van apen?
 Wetenschappers ontdekken hydrothermale ventilatieopeningen op diepe oceaanreis
Wetenschappers ontdekken hydrothermale ventilatieopeningen op diepe oceaanreis Beslissing om de Waters of the United States rule (WOTUS) in te trekken op basis van gebrekkige analyse:studie
Beslissing om de Waters of the United States rule (WOTUS) in te trekken op basis van gebrekkige analyse:studie Hubble gaat diep
Hubble gaat diep Snelle feiten over biomen in de toendra
Snelle feiten over biomen in de toendra  Berg de gereedschapskist op - nieuwe robot monteert IKEA stoelen
Berg de gereedschapskist op - nieuwe robot monteert IKEA stoelen Hoe groot is het probleem van polystyreenvervuiling in de oceaan?
Hoe groot is het probleem van polystyreenvervuiling in de oceaan? Ingenieurs 3D-print vormveranderende slimme gel
Ingenieurs 3D-print vormveranderende slimme gel Op koers voor gezonder, duurzamere bodem
Op koers voor gezonder, duurzamere bodem
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com