
Wetenschap
Platform op nanoschaal heeft tot doel de eiwitniveaus te beheersen
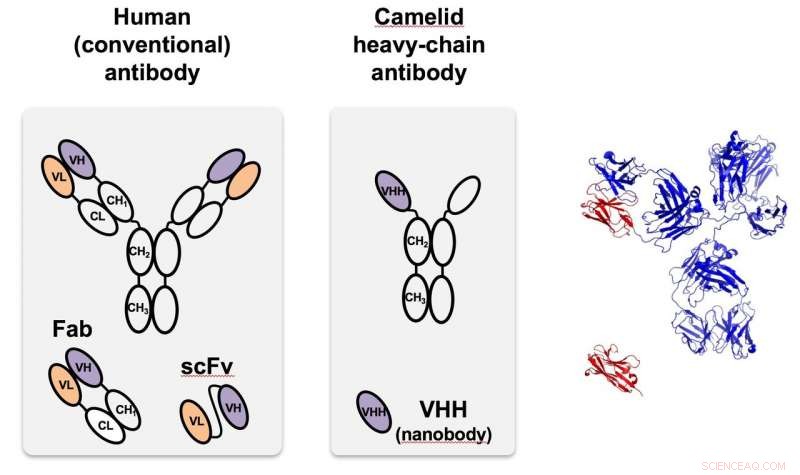
Het kameelachtige nanobody (midden), voor het eerst geïdentificeerd in kamelen, is een antilichaam met een zware keten dat veel kleiner en gemakkelijker te programmeren is dan antilichamen die in de meeste organismen worden aangetroffen, inclusief mensen, zo links. Rechts, de monomere kameelachtige (rood) wordt vergeleken met de structuur van het menselijke antilichaam op ware grootte. VHH is een nanobody die is ontworpen om zich te richten op groene fluorescerende eiwitten die worden gebruikt in proof-of-principle-tests bij Rice. Krediet:Segatori Research Group/Rice University
Een antilichaam op nanoschaal dat voor het eerst werd gevonden in kamelen, gecombineerd met een eiwitafbrekend molecuul, is een effectief nieuw platform om de eiwitniveaus in cellen te controleren, volgens wetenschappers van Rice University. De techniek kan helpen bij fundamenteel onderzoek naar cellulaire dynamiek en bij het ontwerpen van synthetische gencircuits.
Rijst chemisch en biomoleculair ingenieur Laura Segatori, voormalig afgestudeerde student Wenting Zhao en voormalig student Lara Pferdehirt hebben een bifunctioneel herkenningssysteem uitgevonden dat ze NanoDeg noemen. Hierdoor kunnen ze zich richten op specifieke eiwitten in een cel en hun afbraak strikt reguleren.
Het plug-and-play-systeem stelt synthetische biologen in staat om de functie van een specifiek eiwit in de cellulaire omgeving te bestuderen door te beoordelen hoe het eiwitexpressieniveau het leven van een cel beïnvloedt, zei Segatori.
Het onderzoek verschijnt in het tijdschrift American Chemical Society ACS synthetische biologie .
NanoDeg versnelt proteolyse - de enzymatische afbraak van eiwitten - om de niveaus van gerichte eiwitten na translatie onder controle te houden.
Eén functie komt voort uit het enkelketenige antilichaam van kameelachtigen, die kunnen worden aangepast om specifieke eiwitten te targeten. Toen de antilichamen werden ontdekt in kamelen (en later haaien), onderzoekers herkenden snel hun unieke eigenschappen, inclusief hun kleine formaat, hoge oplosbaarheid en het vermogen om zelfs doelen te herkennen die verborgen zijn of zich in tussenliggende toestanden bevinden. Ze zijn veel kleiner dan de antilichamen die van nature in mensen en de meeste andere organismen worden aangetroffen, maar kunnen gemakkelijk worden gemaakt en gewijzigd in bacteriën en andere cellen.
De andere functie is afhankelijk van degrons, korte sequenties in eiwitten die verantwoordelijk zijn voor het reguleren van de snelheid van de afbraak van een eiwit. Deze kunnen ook worden aangepast om de uitputting van een doeleiwit af te stemmen op de gewenste niveaus.
Wanneer gecombineerd als NanoDegs, ze worden een krachtige, universeel platform voor het moduleren van cellulaire eiwitniveaus, zei Segatori.
"Eigenlijk, het stelt ons in staat om de specifieke hoeveelheid eiwitten in cellen te controleren, "zei ze. "We kunnen het aanpassen aan elk eiwit in een cel, en zodra het degron-gelabelde nanobody aan die partner bindt, het hele complex is afgebroken.
"Het voordeel van dit systeem is dat het gericht is op expressie op eiwitniveau, "Zei Segatori. "Typisch, wanneer mensen de hoeveelheid eiwitten in cellen willen moduleren, ze werken op DNA of RNA - het genetische - niveau. Maar door op eiwitniveau te handelen, we kunnen ons richten op verschillende wijzigingen na de regelgeving, en nog veel belangrijker, we hebben veel meer controle over de snelheid en mate van uitputting van het eiwit."
Als bewijs van principe, de onderzoekers ontwierpen een synthetisch gencircuit dat zowel groen fluorescerend eiwit (GFP), die onderzoekers gebruiken om te rapporteren over cellulaire processen, en een NanoDeg die erop gericht is. "We gebruikten GFP omdat het een veelgebruikte reporter is en fluorescentie gemakkelijk te meten is. Segatori zei. "Als het nanobody GFP herkent, het hele complex wordt genomen voor degradatie."
Het zal ook nuttig zijn voor diegenen die schonere informatie willen over de activiteiten van eiwitten in cellen.
"Stel dat je een genetisch circuit ontwerpt waarin GFP-expressie wordt geactiveerd wanneer de cel onder stress staat, zoals uithongering van voedingsstoffen of hitte, bijvoorbeeld, Segatori zei. "Als de cel wordt blootgesteld aan de stimulus, GFP wordt uitgedrukt en u kunt een toename in celfluorescentie detecteren.
"Maar als je de prikkel wegneemt, het verval van het signaal weerspiegelt niet noodzakelijk het verval van de stimulus; het weerspiegelt de stabiliteit van de GFP-reporter, " zei ze. "Wat we hebben gedaan, is een gencircuit creëren waarin GFP-expressie wordt geactiveerd onder stimulus, maar wanneer de stimulus wordt uitgeschakeld, de NanoDeg degradeert GFP zeer snel. Dat verhoogt de gevoeligheid en dynamische resolutie van een synthetisch genencircuit."
 Chemici kristalliseren nieuwe benadering van materiaalwetenschap uit
Chemici kristalliseren nieuwe benadering van materiaalwetenschap uit Zodra we de CO2-uitstoot kunnen opvangen, dit is wat we ermee kunnen doen
Zodra we de CO2-uitstoot kunnen opvangen, dit is wat we ermee kunnen doen Ontdekking binnen het celcyclusproces om inzicht te krijgen in cellulaire ziekten
Ontdekking binnen het celcyclusproces om inzicht te krijgen in cellulaire ziekten Kleine biologisch afbreekbare circuits voor het vrijgeven van pijnstillers in het lichaam
Kleine biologisch afbreekbare circuits voor het vrijgeven van pijnstillers in het lichaam Ingenieurs vinden dat antioxidanten de visualisatie van polymeren op nanoschaal verbeteren
Ingenieurs vinden dat antioxidanten de visualisatie van polymeren op nanoschaal verbeteren
Hoofdlijnen
- Recordaantal walvissen geteld in Patagonië in Argentinië
- Human Heart Science Projects
- Wat is een gespecialiseerd gebied van het endoplasmatisch reticulum?
- Wetenschappers ontdekken patronen van olifantenstroperij in Oost-Afrika
- Niet alle kroontjeskruid is gelijk voor eierleggende monarchen, studie onthult
- Hoe stuifmeel werkt
- De verbazingwekkende diversiteit – en mogelijk verval – van paddenstoelen en andere schimmels
- Hoe zal klimaatverandering de arctische kariboes en rendieren beïnvloeden?
- Kuikenembryo's leveren waardevolle genetische gegevens voor het begrijpen van de menselijke ontwikkeling
- Nieuwe bevindingen over de biomechanica en evolutie van zuigvallen in vleesetende blaasjes
- Nieuwe slangensoort verstopt zich in het volle zicht

- Dennen kappen:eerder vroeger dan later doen is beter voor fynbos

- Batesiaanse mimiek:hoe copycats zichzelf beschermen

- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken

 Het koppelsimulatiemodel van psychologieprofessoren helpt ons in de mysteries van partnerselectie te duiken
Het koppelsimulatiemodel van psychologieprofessoren helpt ons in de mysteries van partnerselectie te duiken ExoMars PanCam-filters
ExoMars PanCam-filters Pandemie onderwijs gaat terug naar de klas met geleerde lessen
Pandemie onderwijs gaat terug naar de klas met geleerde lessen Nieuwe elektrisch geleidende nanodeeltjes van polymeer kunnen warmte genereren om darmkankercellen te doden
Nieuwe elektrisch geleidende nanodeeltjes van polymeer kunnen warmte genereren om darmkankercellen te doden Algen en krill kunnen moeilijk te verkopen zijn voor Europese consumenten
Algen en krill kunnen moeilijk te verkopen zijn voor Europese consumenten Juridische status geen garantie voor werkzekerheid
Juridische status geen garantie voor werkzekerheid De consumptie van thuiswijn is aanzienlijk toegenomen tijdens de opsluiting
De consumptie van thuiswijn is aanzienlijk toegenomen tijdens de opsluiting Easy Electric Science Projects op circuits
Easy Electric Science Projects op circuits
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

