
Wetenschap
Wat kunnen zebravissen ons leren over hoe we overleven als we worden geconfronteerd met mutaties?
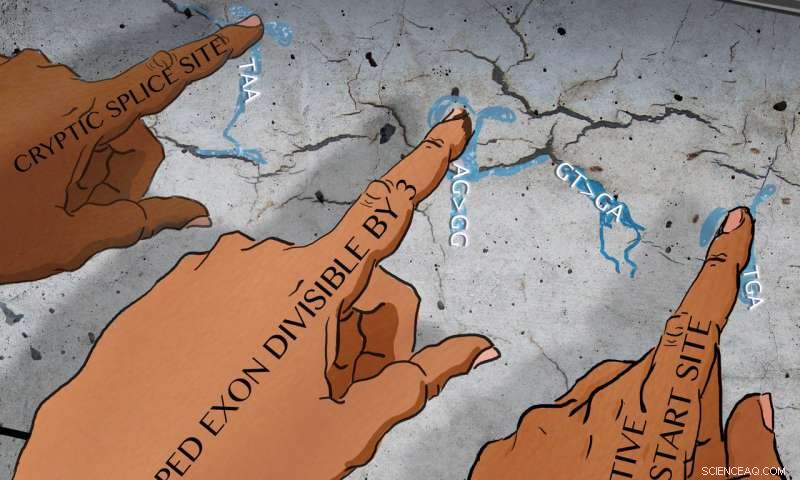
Adaptieve mechanismen zoals activering en gebruik van cryptische splitsingsplaatsen of alternatieve startplaatsen voor transcriptie, evenals nonsens-geassocieerde alternatieve splitsing en overgeslagen exons die het leeskader handhaven, ondersteunen een zee van mutaties waarvan wordt verwacht dat ze voortijdige translatiebeëindiging en functieverlies veroorzaken. Credit:Kunstenaar:Neta Schwartz.
Niet zo lang geleden, biologen zouden mutaties induceren in een heel genoom, een organisme isoleren dat een resulterende ziekte of afwijking vertoonde die ze wilden bestuderen, en werk dan achteruit om te bepalen welk gen verantwoordelijk was voor het defect. Dit proces duurde vaak jaren om definitieve resultaten op te leveren.
Nutsvoorzieningen, dankzij de CRISPR/Cas9-tool voor genoombewerking, biologen kunnen zich richten op specifieke genen voor mutatie en vervolgens zien hoe deze geïnduceerde mutatie zich manifesteert in een organisme - het probleem vanuit de andere richting aanpakken. Maar ze ontdekken dat de verwachte fysieke veranderingen niet altijd plaatsvinden.
Waarom?
Nieuw werk van Carnegie's Steven Farber en Jennifer Anderson vroegen precies dat. Ze keken hoe ze een soort resistentie tegen schadelijke mutaties konden omzeilen die gevonden worden in een gewerveld organisme dat zeer toepasbaar is op mensen - in dit geval, zebravis.
Soms compenseert een organisme een mutatie in een gen door de manier te veranderen waarop het de expressie van andere verwante genen reguleert - een soort tijdelijke oplossing. Andere tijden, cellen omzeilen fouten in het proces waarbij een gen eerst van DNA naar RNA wordt getranscribeerd en vervolgens van RNA naar een eiwit wordt vertaald om een mutatie te compenseren. Bijvoorbeeld, Anderson en haar collega's beschreven gevallen waarin cellen RNA's konden genereren die overleefden door een schadelijke mutatie uit te splitsen. Van deze cellen zou worden verwacht dat ze een eiwit produceren dat een klein stukje mist.
"Het resultaat is misschien niet perfect, maar deze compenserende maatregelen betekenen dat de organismen een deel van de klus kunnen klaren met een minder dan perfect eiwit, Farber zei. "Deze oplossingen laten zien dat vanuit een evolutionair perspectief, we hebben een aantal behoorlijk robuuste mechanismen om ondanks mutaties te blijven overleven."
Dit roept vragen op over hoe mutaties het beste kunnen worden gegenereerd om de genetische basis van ziekte te begrijpen - om de verbazingwekkende efficiëntie van moderne methoden te behouden, maar een manier vinden om enkele van de eigen oplossingen van een organisme te verklaren, die het vermogen van wetenschappers om een schadelijke mutatie te induceren kan remmen.
Ze vinden dat een goede manier om op dit soort genomische oplossingen te jagen, is door naar de RNA-fase te kijken, die de intermediair is tussen gen en eiwit.
"Ons werk laat zien dat het uitvoeren van analyses op RNA-niveau ons kan helpen beter te begrijpen hoe we niet alleen gerichte mutaties kunnen interpreteren, maar ook kunnen ontwerpen, " Farber toegevoegd. "We bieden richtlijnen om de kans te vergroten dat een onderzoeker een gen van belang zal verstoren en uiteindelijk zijn functie zal karakteriseren. Dit soort fundamentele wetenschappelijke benadering versnelt de ontwikkeling van diagnostiek en therapie voor een groot aantal menselijke ziekten en aandoeningen."
Het onderzoeksteam omvatte ook Carnegie's Timothy Mulligan en Meng-Chieh Shen, evenals medewerkers van de laboratoria Du (University of Maryland School of Medicine) en Busch-Nentwich (Wellcome Trust Sanger Institute).
De studie is gepubliceerd in PLOS Genetica .
 Hoe kooldioxide te maken
Hoe kooldioxide te maken  Kader om het pad van individuele koolstofatomen te volgen
Kader om het pad van individuele koolstofatomen te volgen Kunstmatige bio-geïnspireerde membranen voor waterfiltratie
Kunstmatige bio-geïnspireerde membranen voor waterfiltratie Capaciteit van dunne films die gepolymeriseerde ionische vloeistoffen bevatten
Capaciteit van dunne films die gepolymeriseerde ionische vloeistoffen bevatten Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd
Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd
Hoofdlijnen
- Is de behoefte aan privacy evolutionair?
- Zijn gelukkige mensen gezonder?
- Hoe rouw werkt
- Pesticiden en slechte voeding schaden de diergezondheid
- Nieuwe insectensoort bootst dode bladeren na voor camouflage
- Hoe succesvol te zijn in de microbiologie
- Een natte winter kan de invasieve soorten van San Francisco Bay opschudden
- 10 misvattingen over de griep
- Verschil tussen gekoppelde en vrijstaande ribosomen
- Ziekteverwekkers tegen elkaar keren om resistentie tegen geneesmiddelen te voorkomen
- High School Biology Experiment Ideas

- Hogere biodiversiteit door rivierverruimende maatregelen

- Getoonde chimpansees die spontaan om de beurt een cijferpuzzel oplossen

- Waarom het de menselijke natuur is om onze instincten te negeren

 Röntgenbron 3XMM J000511.8+634018 is een polaire, studie suggereert:
Röntgenbron 3XMM J000511.8+634018 is een polaire, studie suggereert: Amerikanen raken steeds meer sociaal geïsoleerd, maar ze voelen zich niet eenzamer
Amerikanen raken steeds meer sociaal geïsoleerd, maar ze voelen zich niet eenzamer De Olympische Spelen van Tokyo kunnen bekend worden als de Robot Games
De Olympische Spelen van Tokyo kunnen bekend worden als de Robot Games Holografische beeldvorming kan worden gebruikt om tekenen van leven in de ruimte te detecteren
Holografische beeldvorming kan worden gebruikt om tekenen van leven in de ruimte te detecteren Vrouwen schaars in de ene procent:Glazen plafond is groter dan gedacht studie toont
Vrouwen schaars in de ene procent:Glazen plafond is groter dan gedacht studie toont Tienerouders voelen zich geïsoleerd op school en missen professionele leermogelijkheden
Tienerouders voelen zich geïsoleerd op school en missen professionele leermogelijkheden Glitter helpt oceaangolven te volgen
Glitter helpt oceaangolven te volgen Hoe wetenschappers nieuwe kleuren uitvinden
Hoe wetenschappers nieuwe kleuren uitvinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

