Wetenschap
Onderzoek naar nanodragers toont tumorspecifieke geneesmiddelafgifte aan via gecontroleerde endosomale ontsnapping
Geneesmiddelen op basis van eiwitten moeten zo naar de cellen worden getransporteerd dat hun onmiddellijke afbraak wordt voorkomen. Een nieuwe aanpak moet ervoor zorgen dat ze alleen in bepaalde cellen intact blijven, zoals kankercellen. Dat blijkt uit een onderzoek gepubliceerd in het tijdschrift Angewandte Chemie International Edition heeft een Japans onderzoeksteam een nanocarrier geïntroduceerd die uit endosomen kan ‘ontsnappen’ voordat de lading daar wordt vernietigd. Dit vermogen om te ontsnappen wordt alleen geactiveerd binnen de endosomen van bepaalde tumorcellen.
De opname van nanodragers in cellen vindt plaats door endocytose:wanneer een nanodrager op het celoppervlak terechtkomt, vouwt het celmembraan zich naar binnen en omsluit het in een bel, een zogenaamde endosoom, die vervolgens naar het binnenste van de cel drijft. In de late fase versmelt het endosoom met lysosomen die enzymen bevatten, waardoor een endolysosoom ontstaat. Binnen deze structuur breken de enzymen zowel materiaal uit het lichaam als lichaamsvreemd materiaal af.
Een medicijn op basis van eiwitten kan alleen actief worden als het uit het endolysosoom "ontsnapt" voordat het wordt afgebroken. Dit staat bekend als 'endosomale ontsnapping'. Sommige nanodragers kunnen het endo/lysosomale membraan openen en hebben daardoor endosomaal ontsnappingsvermogen.
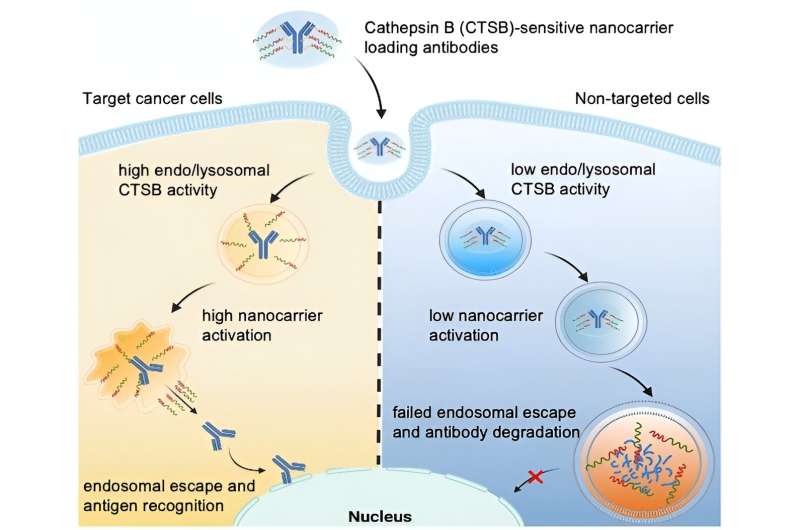
Onder leiding van Kazunori Kataoka en Horacio Cabral wil het team nog een stap verder gaan door nanodragers te produceren waarvoor endosomale ontsnapping alleen wordt geactiveerd wanneer ze zeer specifieke cellen binnendringen, zoals tumorcellen. Dit zou gezonde cellen beschermen. De onderzoekers maken gebruik van het feit dat verschillende soorten cellen zeer verschillende endolysosomale enzymactiviteiten hebben. Zo is de activiteit van het protease cathepsine B (CTSB) vooral hoog in kankercellen.
Met behulp van speciale fluorescentiesondemoleculen bestudeerde het team van de Universiteit van Tokio en het Kawasaki Institute of Industrial Promotion aanvankelijk CTSB-activiteit en eiwitafbraak in endosomen. Ze stelden vast dat in kankercellen met zeer zure endosomen de CTSB-activiteit in hun vroege fase al erg hoog is – aanzienlijk voordat de eiwitafbraak toeneemt. De onderzoekers profiteren van dit tijdsbestek door nanocarriers te gebruiken waarvan het endosomale ontsnappingsvermogen wordt geactiveerd door de CTSB in kankercellen.
Het team construeerde op poly(ethyleenglycol) gebaseerde nanodragers met diaminoethaangroepen die in staat zijn endo/lysosomale membranen "open te scheuren". Met behulp van een linker bevestigden ze vervolgens antilichamen die als model voor een eiwitmedicijn moesten dienen. De nanodrager schermt de "scheurgereedschappen" af, zodat deze in eerste instantie inactief zijn.
De linker is ontworpen om door de CTSB in de endolysosomen te worden gesplitst. Hierdoor wordt de lading gescheiden van de drager en worden de scheurgereedschappen geactiveerd. Ze openen het endo/lysosomale membraan en laten intacte antilichamen vrij in het celinterieur, maar alleen in tumorcellen met verhoogde endosomale CTSB-activiteit.
Deze methode zou een nieuwe strategie kunnen vertegenwoordigen voor de celspecifieke afgifte van medicijnen via stimulus-responsieve nanodragers met gecontroleerde endosomale ontsnapping.
Meer informatie: Pengwen Chen et al, Selectieve intracellulaire afgifte van antilichamen in kankercellen met nanocarriers die endo/lysosomale enzymatische activiteit detecteren, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317817
Journaalinformatie: Angewandte Chemie Internationale Editie
Aangeboden door Wiley
 Een wereldwijde verschuiving van noord naar zuid in windenergie tegen het einde van de eeuw
Een wereldwijde verschuiving van noord naar zuid in windenergie tegen het einde van de eeuw Ophoping van fracking afvalwater gevonden in zoetwatermosselenschelpen
Ophoping van fracking afvalwater gevonden in zoetwatermosselenschelpen Wetenschappers ontwikkelen een nieuwe methode voor het kwantificeren van onzichtbare plastics in rivieren
Wetenschappers ontwikkelen een nieuwe methode voor het kwantificeren van onzichtbare plastics in rivieren  De menselijke kosten van de ontwikkeling van palmolie
De menselijke kosten van de ontwikkeling van palmolie Hittestress kan tegen 2100 jaarlijks meer dan 1,2 miljard mensen treffen
Hittestress kan tegen 2100 jaarlijks meer dan 1,2 miljard mensen treffen
Hoofdlijnen
- Wat bepaalt de productie van eiwitten in uw lichaam?
- Is diepgevroren kabeljauw net zo lekker als vers?
- Jacht op herten beperkt in westelijke Amerikaanse staten na strenge winter
- Zou de micro-ecologie worden beschadigd door een plastic film die een schadelijk bodeminsect doodt?
- Onverwachte regulatie van transcriptiefactoren die cruciaal zijn voor ontwikkeling
- Wat vertellen crowdsourced foto's langs wandelpaden ons over het klimaat?
- Wat gebeurt er nadat u een wortel in zout water hebt gestopt?
- De rol van microfilamenten in cytokinese
- De soorten elektroforese
 Hoe hittegolven het Arctische fytoplankton beïnvloeden
Hoe hittegolven het Arctische fytoplankton beïnvloeden  Voorbij geluid:roodoogboomkikkers gebruiken geluid en trillingen bij het zoeken naar vrienden en agressie
Voorbij geluid:roodoogboomkikkers gebruiken geluid en trillingen bij het zoeken naar vrienden en agressie Koolstofbubbel komt eraan die biljoenen van de wereldeconomie kan wegvagen:studie
Koolstofbubbel komt eraan die biljoenen van de wereldeconomie kan wegvagen:studie Lijst met geleiders
Lijst met geleiders  Voorbeelden van ontbossing
Voorbeelden van ontbossing  Over de oorsprong van massieve sterren
Over de oorsprong van massieve sterren Inhaleerbare moleculen neutraliseren SARS-CoV-2 bij muizen
Inhaleerbare moleculen neutraliseren SARS-CoV-2 bij muizen  Computers maken, mobiele apparaten energiezuiniger
Computers maken, mobiele apparaten energiezuiniger
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com