
Wetenschap
Op DNA-origami gebaseerd vaccinplatform verbetert de antitumorreacties door nanometer-precieze afstand van moleculen
Therapeutische kankervaccins zijn een vorm van immunotherapie in wording die niet alleen kankercellen bij patiënten kan vernietigen, maar ook kan voorkomen dat kanker terugkomt en zich verspreidt. Er worden meerdere therapeutische kankervaccins bestudeerd in klinische onderzoeken, maar ondanks hun belofte worden ze nog niet routinematig gebruikt door klinische oncologen om hun patiënten te behandelen.
Het centrale ingrediënt van therapeutische kankervaccins zijn antigenen, die bij voorkeur worden geproduceerd of nieuw worden geproduceerd (neoantigenen) door tumorcellen en het immuunsysteem van een patiënt in staat stellen de kankercellen te zoeken en te vernietigen.
In de meeste gevallen kunnen deze antigenen niet alleen werken en hebben ze de hulp nodig van adjuvante moleculen die een algemeen alarmsignaal veroorzaken in immuuncellen die bekend staan als antigeenpresenterende cellen (APC's). APC's internaliseren zowel antigeen- als adjuvansmoleculen en presenteren de antigenen aan verschillende soorten T-cellen. Die T-cellen lanceren dan een onmiddellijke aanval op de tumor, of bewaren een langduriger geheugen van de tumor voor toekomstige verdediging.
De effectiviteit van een kankervaccin hangt af van het niveau en de duur van het ‘alarm’ dat de adjuvantia kunnen laten klinken bij APC’s. Eerder ontdekten onderzoekers dat het gelijktijdig afleveren van adjuvans- en antigeenmoleculen aan APC's met behulp van nanostructuren zoals DNA-origami de APC-activatie kan verhogen. Geen van deze benaderingen heeft echter systematisch onderzocht hoe het aantal en de rangschikking van adjuvansmoleculen op nanoschaal de stroomafwaartse tumorgerichte immuniteit beïnvloeden.
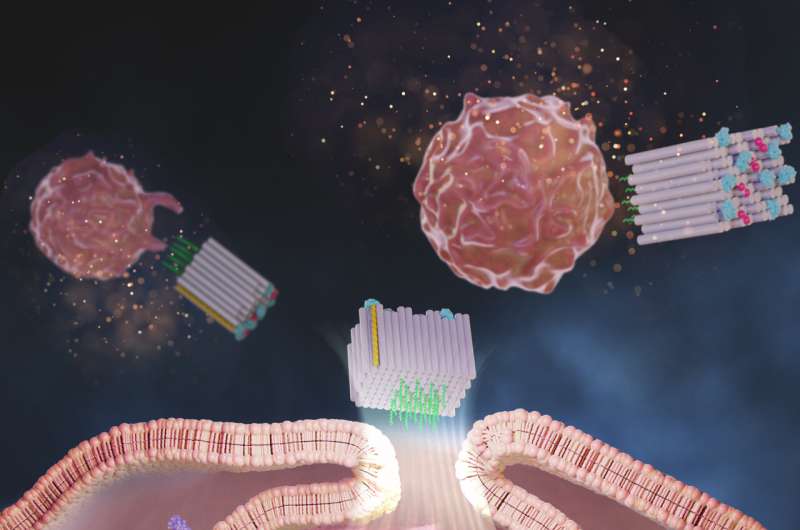
Nu heeft een onderzoeksteam van het Wyss Institute van de Harvard University, het Dana-Farber Cancer Institute (DFCI), de Harvard Medical School (HMS) en het Korea Institute of Science and Technology (KIST) een DNA-origamiplatform gecreëerd genaamd DoriVac, waarvan de kern component is een zelfassemblerende vierkante blokvormige nanostructuur.
Aan de ene kant van het vierkante blok kunnen gedefinieerde aantallen adjuvansmoleculen worden vastgemaakt in zeer afstembare, nanoprecieze patronen, terwijl de andere kant tumorantigenen kan binden. Uit de studie bleek dat moleculen van een adjuvans bekend als CpG op een afstand van precies 3,5 nanometer van elkaar resulteerden in de meest gunstige stimulatie van APC's die een zeer wenselijk profiel van T-cellen induceerden, inclusief die welke kankercellen doden (cytotoxische T-cellen). degenen die gunstige ontstekingen veroorzaken (Th-1 gepolariseerde T-cellen), en degenen die zorgen voor een langdurig immuungeheugen van de tumor (geheugen-T-cellen).
Dankzij DoriVac-vaccins konden tumordragende muizen de groei van tumoren beter controleren en aanzienlijk langer overleven dan controlemuizen. Belangrijk is dat de effecten van DoriVac ook synergiseerden met die van immuuncheckpointremmers, een zeer succesvolle immunotherapie die al op grote schaal in de kliniek wordt gebruikt. De bevindingen zijn gepubliceerd in Nature Nanotechnology .
"DoriVac's DNA-origami-vaccintechnologie combineert verschillende nanotechnologische mogelijkheden die we in de loop der jaren hebben ontwikkeld met een steeds diepere kennis over kankeronderdrukkende immuunprocessen", zegt William Shih, Ph.D., lid van de Wyss Core Faculty, die leiding gaf aan het team van het Wyss Institute. samen met eerste auteur Yang (Claire) Zeng, M.D., Ph.D..
"Wij voorzien dat antigenen die bij patiënten met verschillende soorten tumoren zijn geïdentificeerd in de toekomst snel kunnen worden geladen op geprefabriceerde, adjuvans bevattende DNA-origami om zeer effectieve gepersonaliseerde kankervaccins mogelijk te maken die kunnen worden gecombineerd met door de FDA goedgekeurde controlepuntremmers in combinatietherapieën. "
Shih is ook hoogleraar aan de afdeling Kankerbiologie van HMS en DFCI en, net als sommige andere auteurs, lid van het interinstitutionele centrum "Immuno-engineering to Improve Immunotherapy" (i3), gevestigd in de Wyss.
De grondgedachte van DNA-origami
Het CpG-adjuvans is een synthetische DNA-streng die bestaat uit herhaalde CpG-nucleotidemotieven die het genetische materiaal nabootsen van bacteriële en virale pathogenen die immuuncellen binnendringen. Net als zijn natuurlijke tegenhangers binden CpG-adjuvantia zich in immuuncellen aan een ‘gevaarreceptor’ genaamd TLR9, die op zijn beurt een inflammatoire (aangeboren) immuunrespons induceert die samenwerkt met de door antigeen geïnduceerde (adaptieve) immuunrespons.
“We wisten uit eerder werk dat TLR9-receptoren, om sterke ontstekingsreacties teweeg te brengen, moeten dimeriseren en aggregeren tot multimere complexen die binden aan meerdere CpG-moleculen. De afstanden op nanoschaal tussen de CpG-bindende domeinen in effectieve TLR9-assemblages, onthuld door structurele analyse, vielen precies in de van wat we veronderstelden te kunnen weerspiegelen met DNA-origami-structuren die precies op afstand van elkaar geplaatste CpG-moleculen presenteren”, legt Zeng uit, die ten tijde van het onderzoek instructeur in de geneeskunde was en nu senior wetenschapper is aan DFCI en de Harvard Medical School (HMS).
Naast Shih werd Zeng bij het project ook begeleid door senior auteurs Ju Hee Ryu, Ph.D., hoofdonderzoeker bij KIST, en Wyss Founding Core Faculty-lid David Mooney, Ph.D., die ook professor is aan Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS), en een van de hoofdonderzoekers van het i3 Center.
Zeng en het team vervaardigden DoriVac-vaccins waarin verschillende aantallen CpG-strengen op een afstand van 2,5, 3,5, 5 of 7 nanometer van elkaar waren geplaatst aan de ene zijde van het vierkante blok, en een modelantigeen aan de andere zijde was bevestigd. Ze beschermden hun structuren tegen afbraak in het lichaam met behulp van een chemische modificatiemethode die de groep van Shih eerder had ontwikkeld.
Wanneer geïnternaliseerd door verschillende soorten APC's, waaronder dendritische cellen (DC's), die tumorgerichte T-celreacties orkestreren, verbeterden de DoriVac-vaccins de opname van antigenen vergeleken met controles bestaande uit vrije antigeenmoleculen.
Een CpG-afstand van 3,5 nanometer produceerde de sterkste en gunstigste reacties bij APC's en presteerde aanzienlijk beter dan een controlevaccin dat alleen vrije CpG-moleculen bevatte.
"We waren verheugd toen we ontdekten dat het DoriVac-vaccin bij voorkeur een immuunactiveringstoestand induceerde die de antitumorale immuniteit ondersteunt, wat onderzoekers over het algemeen willen zien in een goed vaccin", aldus Zeng.
Naast de onderlinge afstand waren ook de aantallen CpG-moleculen in DoriVac-vaccins van belang. Het team testte vaccins die tussen de 12 en 63 optimaal verdeelde CpG-moleculen bevatten en ontdekte dat 18 CpG-moleculen de beste APC-activatie opleverden. Dit betekende dat hun aanpak ook kan helpen de dosering van CpG-moleculen te beperken en zo vaak waargenomen toxische bijwerkingen die worden waargenomen bij adjuvantia te minimaliseren.
Verkregen in (tumor)translatie
Belangrijk is dat deze in vitro trends zich vertaalden naar in vivo muistumormodellen. Wanneer de DoriVac-vaccins profylactisch onder de huid van muizen werden geïnjecteerd, hoopten ze zich op in de dichtstbijzijnde lymfeklieren, waar ze DC's stimuleerden.
Een vaccin geladen met een melanoomantigeen verhinderde de groei van vervolgens geïnjecteerde agressieve melanoomcellen. Terwijl alle controledieren op dag 42 van het experiment aan de kanker waren bezweken, leefden de door DoriVac beschermde dieren allemaal.
DoriVac-vaccins remden ook de tumorgroei bij muizen waarbij de vorming van melanoomtumoren al aan de gang was, waarbij een afstand van 3,5 nanometer van 18 CpG-moleculen opnieuw maximale effecten op DC- en T-cellen opleverde, en de sterkste vermindering van de tumorgroei.
Vervolgens vroeg het team zich af of DoriVac-vaccins ook de immuunreacties zouden kunnen stimuleren die worden geproduceerd door kleine ‘neo-antigenen’ die opduiken in melanoomtumoren.
Neoantigenen zijn ideale doelwitten omdat ze uitsluitend door tumorcellen worden gemaakt. Ze zijn echter zelf vaak niet erg immunogeen, waardoor zeer effectieve adjuvantia een belangrijk onderdeel zijn van neoantigeenvaccins. Een DoriVac-vaccin aangepast met vier neoantigenen stelde de onderzoekers in staat de groei van de tumor aanzienlijk te onderdrukken bij muizen die de neoantigenen produceerden.
Ten slotte vroegen de onderzoekers zich af of DoriVac zou kunnen samenwerken met immuuncontrolepunttherapie, die T-cellen reactiveert die in tumoren tot zwijgen zijn gebracht.
Bij muizen resulteerden de twee gecombineerde therapieën in de totale regressie van melanoomtumoren en voorkwamen ze dat ze teruggroeiden toen de dieren vier maanden later opnieuw aan dezelfde tumorcellen werden blootgesteld. De dieren hadden een immuungeheugen van de tumor opgebouwd. Het team behaalde een vergelijkbare vaccinatie-efficiëntie in een muizenlymfoommodel.
"Wij denken dat de waarde van DoriVac voor het bepalen van een goede plek in de afgifte van adjuvans en het verbeteren van de afgifte en effecten van gekoppelde antigenen de weg kan vrijmaken voor effectievere klinische kankervaccins voor gebruik bij patiënten met een verscheidenheid aan kankers", aldus Zeng.
Het team vertaalt momenteel het DoriVac-platform naar zijn klinische toepassing, die wordt ondersteund door de beoordeling van de vaccindistributie en vaccingerichte antilichamen bij muizen, evenals cytokines geproduceerd door immuuncellen als reactie op de vaccins in vivo.
“Het DoriVac-platform is ons eerste voorbeeld van hoe ons streven naar wat wij Molecular Robotics noemen – synthetische bio-geïnspireerde moleculen met programmeerbare vorm en functie – kan leiden tot geheel nieuwe en krachtige therapieën. Deze technologie opent een geheel nieuw pad voor de ontwikkeling van designervaccins met eigenschappen die zijn afgestemd op specifieke klinische uitdagingen. We hopen dat de toepassing ervan snel in de kliniek zal worden toegepast”, aldus oprichter van Wyss Institute, Donald Ingber, M.D., Ph.D.